
Infección del tracto urinario (ITU)
Fecha de actualización: 29/01/2024
(V.2.0/2024)
La infección del tracto urinario (ITU) se define como la presencia en el tracto urinario de bacterias, con un crecimiento significativo en una muestra de orina obtenida mediante una técnica adecuada, y variable en función del método de recogida1, junto con una combinación de signos y síntomas que variarán según la localización y edad del paciente2. En los menores de dos años, y sobre todo en los lactantes más pequeños, la clínica es mucho más inespecífica y la clasificación anatómica difícil de establecer. En la práctica clínica resulta más adecuado diferenciar entre ITU febril y afebril. Sin embargo, la presencia de fiebre no siempre supondrá afectación del parénquima renal y en menores de tres meses esta puede cursar sin fiebre.
Aproximadamente el 1-2% de los niños y el 3-5% de las niñas padecerán al menos 1 episodio. La prevalencia de ITU en niños febriles varía en función de la edad (mayor en menores de 1 año) y el sexo (mayor en niñas mayores de 6 meses), con prevalencias más elevadas en presencia de temperatura >39ºC3.
Aunque en la mayor parte de los casos el pronóstico es favorable, las ITU tienen riesgo de producir daño renal definitivo, por afectación del parénquima renal (pielonefritis aguda, PNA). El tratamiento precoz se correlaciona con una disminución del riesgo de causar cicatrices renales. Actualmente se reconoce una predisposición individual y genética a padecer ITU (polimorfismos que condicionan mayor susceptibilidad), y una serie de factores de riesgo4 que favorecen su aparición o la de complicaciones renales5. La idea de que las anomalías del tracto urinario y sobre todo el reflujo vésico-ureteral (RVU) pueden aumentar el riesgo de padecer ITU febril/PNA o complicaciones, probablemente sea más relevante en casos de RVU de alto grado. Las recidivas1 son frecuentes después de una primera ITU; el 50% de las niñas presentarán otra en el primer año, y el 75% en los 2 años siguientes; en el caso de los varones no hay datos definitivos, pero las recidivas son comunes en los menores de 1 año e infrecuentes en los mayores de esta edad.
Solo debe considerarse el diagnóstico de ITU en presencia de sintomatología compatible2. Sin embargo, pocas características clínicas son útiles para diagnosticar o descartar ITU6 sin realizar análisis de orina. Aunque el diagnóstico se establece mediante el urocultivo (UC), hallazgos en la orina como la leucocituria o los nitritos servirán para apoyar un diagnóstico de sospecha. Sin embargo, la ausencia de piuria en presencia de factores de riesgo de ITU o una alta sospecha clínica no la descarta.
Los signos y síntomas combinados en una regla de predicción clínica, como la puntuación DUTY o UTIcalc, podrían aumentar la precisión para descartar ITU.
Actualmente se acepta la validez de la tira de orina o del urinoanálisis en lactantes de 16 a 90 días de edad con fiebre sin foco (FSF) de corta evolución para orientar el inicio o no de antibioticoterapia empírica, junto con otras pruebas complementarias (reactantes de fase aguda), que permitan seguimiento clínico.
Las dificultades para recoger muestras de orina válidas constituyen los retos clínicos específicos de esta patología, siendo preferible el sondaje vesical y la punción suprapúbica en los niños incontinentes, aunque se puede considerar la recogida al acecho con o sin estimulación.
Todo niño con el diagnóstico presuntivo de ITU necesita ser tratado con antimicrobianos de forma empírica una vez recogidas las muestras para cultivo mediante una técnica adecuada. La elección del tratamiento antibiótico empírico inicial debe ajustarse a los patrones locales de prevalencia de agentes y su sensibilidad a los antimicrobianos. Escherichia coli es el agente etiológico más frecuente en niños sin uropatías previas. En nuestro medio, E. coli presenta un alto porcentaje de resistencia a ampicilina, cotrimoxazol y cefalosporinas de 1ª generación, e incluso a amoxicilina clavulánico, aunque este último antibiótico muestra mayor variabilidad entre diferentes áreas, mientras que mantiene una alta sensibilidad a cefalosporinas de segunda y tercera generación, fosfomicina, nitrofurantoína y aminoglucósidos.
Es notoria la marcada variabilidad en el manejo práctico de la ITU infantil en nuestro medio, sobre todo en lo referido al uso de las pruebas de imagen, reflejo probablemente de las escasas evidencias disponibles.
|
Agentes causales |
|
|
Frecuentes |
Menos frecuentes7 |
|
Escherichia coli8 |
Klebsiella sp, Proteus mirabilis9; otras enterobacterias10 Pseudomonas aeruginosa Enterococcus faecalis11 Staphylococcus saprophyticus12 Estreptococos del grupo B11, Staphylococcus aureus; otras bacterias Candida13; otros hongos Adenovirus14 |
|
Estudios complementarios |
||
|
|
Evaluación inicial |
Seguimiento / situaciones especiales |
|
En consulta |
Tira de orina reactiva15 |
|
|
Laboratorio |
Examen del sedimento: Microscopía automatizada / Citometría de flujo15 |
Hemograma, PCR, PCT, Interleukina-6, Urea, Creatinina, Iones16 Osmolalidad urinaria máxima y otros marcadores17 |
|
Microbiología |
UC18 y antibiograma, sistemas semiautomáticos para cultivo y detección rápida19 |
Hemocultivo, si sospecha sepsis Microscopía con tinción de Gram20 |
|
Pruebas de Imagen |
No indicadas con carácter rutinario |
Ecografía, Gammagrafía, Cistografía |
|
Pruebas de imagen en ITU21 |
|
|
Estudio |
Recomendación en |
|
Ecografía22 |
Valorar en:
|
|
Cistografía25 |
Excepcionalmente valorar en:
|
|
Gammagrafía renal DMSA28 |
Excepcionalmente valorar en: |
|
Indicaciones de ingreso31 |
|
|
Generales 32 |
|
|
Relativas35 |
|
|
Derivación a Atención Especializada36 |
|
Situación |
Tratamiento de elección43 |
Alternativas |
|
|
< 3 meses |
Ampicilina IV45+
|
Según antibiograma |
|
|
>3 meses |
Aminoglucósido IV/IM46,47 o Cefotaxima IV/IM46,47 +/- Amplimicina IV45 |
Ceftriaxona IM/IV48 Amoxicilina/clavulánico IV49 Cefuroxima IV50 |
|
|
Pacientes con riesgo de germen atípico51 |
Aminoglucósido IV (preferentemente amikacina)46,47 +/- Ampicilina45 |
Ceftazidima IV +/- Ampicilina45
Meropenem IV +/- |
|
|
ITU febril sin criterios de ingreso hospitalario42 |
|||
|
ITU no febril (con clínica compatible con infección urinaria baja/cistitis) |
Fosfomicina trometamol56 VO o Nitrofurantoina VO o Cefuroxima axetilo VO50 o Fosfomicina cálcica VO57 |
Amoxicilina clavulánico VO (4:1)49,55 Cotrimoxazol VO49 en mayores de 2 años |
|
|
Duración del tratamiento |
Cuando tras un diagnóstico de presunción, se comprueba que el UC es negativo, se recomienda suspender el tratamiento antimicrobiano58 |
|
Dosis recomendadas |
|
Amikacina, IV/IM: 15-22,5 mg/kg/día en una sola dosis59 Amoxicilina/clavulánico 10:1, IV: 100-150 mg/kg/día de amoxicilina, en 4 dosis (máximo 3 000 mg amoxicilina/600 mg ácido clavulánico) Amoxicilina/clavulánico 4:1, VO: 40-50 mg (de amoxicilina) /kg/día, en 3 dosis (máximo ácido clavulánico 125 mg por dosis) Ampicilina, IV: 100-200 mg/kg/día, en 4 dosis (máximo 12 g/día) Cefixima, VO: 8 mg/kg/día, en 1-2 dosis (máximo 400 mg/día. En PNA/ITU febril dos dosis) Cefotaxima, IV: 100-200 mg/kg/día, en 3-4 dosis (máximo 12 g/día) Ceftazidima: >7 días y niños <40 kg sin infección meníngea: 100-150 mg/kg/día, en 3 dosis (máximo 6 g/día) IV; >40 kg 1-2 g, IM/ IV, cada 8 h. Ceftriaxona, IV/IM: 50-75 mg/kg/día, en 1-2 dosis (máximo 1 g/día, 2-4 g/día en infecciones graves) Cefuroxima, IV: 100-150 mg/kg/día, en 3 dosis (máximo 9 g/día) Cefuroxima axetilo, VO: 30-40 mg/kg/día (dosis altas para ITU febril o menores de 2 años) o 15-20 mg/kg/día (en ITU afebril en mayores de 2 años), en 2 dosis por día (máximo 1 g/día) Ciprofloxacino IV: 18-30 mg/kg/día, cada 8 h (dosis máxima: 1200 mg/día); VO: 20-40 mg/kg/día, cada 12 h (dosis máxima: 1 500 mg/día) Cotrimoxazol, VO: TMP 8 mg + SMX 40 mg/kg/día, en 2 dosis (máximo TMP 320 mg/día, SMX 1600 mg/día) Fosfomicina cálcica, VO: 100 mg/kg/día, en 3 dosis; En la actualidad es un tratamiento off-label en menores de 12 años (máximo 3 g/día) Fosfomicina/trometamol, VO: 3 g en dosis única en mayores de 12 años Gentamicina, IV/IM: 5-7,5 mg/kg/día, en 1 dosis59 Meropenem IV: mayor de 7 días hasta 50 kg de peso: 10-20 mg/kg cada 8 horas; más de 50 kg de peso, 500-1 000 mg cada 8 horas Nitrofurantoína, VO: 5-7 mg/kg/día, en 4 dosis (máximo 400 mg/día) Teicoplanina IV/IM: 10 mg/kg cada 12 horas, las 3 primeras dosis; a continuación, 6 mg/kg/día en una sola dosis. Tobramicina, IV/IM: Niños mayores de 1 semana la dosis es de 5-7,5 mg/kg/día una dosis día. A partir de los 40 kg se dosificará a 3 mg/kg/día en 1 dosis IV o IM60 |
|
Otras medidas terapéuticas/de soporte |
|
|
Indicaciones de profilaxis antibiótica61 |
|
Otras medidas que pueden evitar recurrencias de ITU |
|
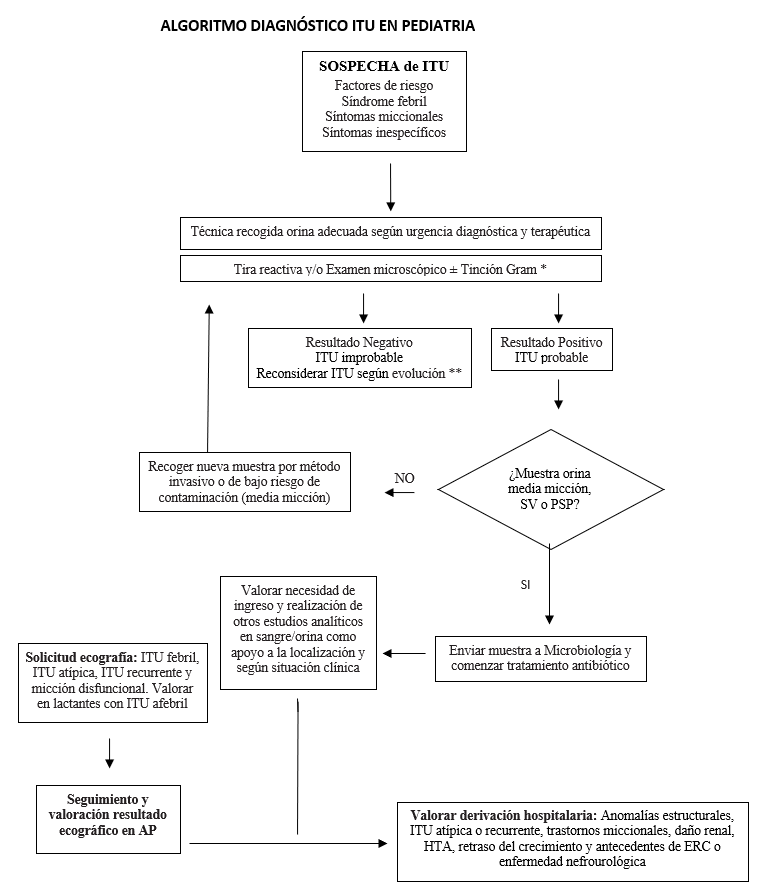
Modificado de “Infección de vías urinarias en la infancia”. Protoc diagn ter pediatr. 2022. AEP
* Siempre que sea posible, se recomienda realizar una tinción de Gram para orientar el tratamiento empírico inicial en menores de 3 meses y en pacientes con malformación de la vía urinaria. Podría obviarse su realización ante la presencia de nitritos en una orina recién emitida.
** La ausencia de alteraciones no permite descartar la existencia de IU. Valorar según evolución, escenario clínico y antecedentes.
| Referencias bibliográficas |
|
Abreviaturas: CUMS: cistografía miccional seriada. DMSA: gammagrafía con ácido dimercaptosuccínico marcado con Tc99. ERC: enfermedad renal crónica. FSF: fiebre sin foco. HTA: hipertensión arterial. IM: vía intramuscular. ITU: infección del tracto urinario. IV: vía intravenosa. PA: presión arterial. PCR: proteína C reactiva. PCT: procalcitonina. PNA: pielonefritis aguda. PSP: punción suprapúbica. RVU: reflujo vésico-ureteral. SMX: sulfametoxazol. SNC: sistema nervioso central. SV: sondaje vesical. TC: tomografía computadorizada. TMP: trimetoprim. Ufc: unidad formadora de colonias. VO: vía oral. VPN: valor predictivo negativo. VPP: valor predictivo positivo.
1
Definiciones
Bacteriuria asintomática (BA)
Aislamiento de microorganismos en cantidad significativa en orina
recogida de manera estéril en un paciente asintomático. Es más
frecuente en niñas y en vejigas neurógenas. Incidencias entre 0,5-3%. No debe
tratarse de manera rutinaria
Piuria estéril
Presencia de leucocituria en sedimento urinario o esterasa leucocitaria positiva en
tira reactiva en ausencia de crecimiento de microorganismos en UC. Puede asociarse a ITU
parcialmente tratada, tuberculosis, ITU por otros microorganismos no bacterianos (hongos,
virus), deshidratación, fiebre, cristaluria/litiasis, cuerpo extraño,
apendicitis, vulvovaginitis/balanitis, nefritis intersticial, o necrosis papilar.
Además, a ciertas entidades inmunológicas como enfermedad de Kawasaki, lupus
eritematoso sistémica o nefropatía medicamentosa (AINEs)
ITU vías bajas, inferior o cistitis aguda
ITU localizada únicamente en las vías urinarias. Suele asociarse a
sintomatología local de irritación vesical (escozor miccional, polaquiuria,
disuria)
Pielonefritis aguda (PNA)
ITU que afecta al parénquima renal. Suele asociarse a sintomatología general
(fiebre) y local variable. Su principal riesgo incluye el desarrollo de cicatrices
permanentes en el parénquima renal que ocasionen una disminución de la
función renal con morbilidad importante
ITU recurrente
Dos o más episodios de PNA; un episodio de PNA y uno o más de cistitis,
o tres episodios o más de cistitis, con un intervalo libre de síntomas de 2
semanas para considerar una reinfección
ITU atípica
Aquellas en las que:
2
Síntomas y signos
Edad/condición Frecuentes + - Frecuentes <3 meses Fiebre Pérdida apetito Dolor abdominal >3 meses Preverbal/no continente Fiebre Dolor abdominal o en flanco. Letargia Verbal/continente Frecuencia miccional. Micción disfuncional Fiebre,Malestar. La sepsis urinaria es más común en los lactantes
⟷
Vómitos
Letargia
Irritabilidad
Fallo de medro
Ictericia
Hematuria
Orina maloliente
Vómitos
Pérdida de peso
Irritabilidad
Hematuria
Orina maloliente
Fallo de medro
Disuria
Cambios en continencia.
Dolor abdominal o en el flanco
Vómitos.
Hematuria.
Orina maloliente.
Orina turbia
Fiebre se define como Ta>38ºC.
3
Prevalencia ITU
Edad en meses
Niños (% IC 95%)
Niñas (% IC 95%)
p
0-3
43,3% (31,5-55,9)
22,8% (11,8-39,2)
0,07
3-6
28,1% (21,0-36,4)
21,2% (14,1-30,6)
0,31
6-12
7,7% (5,4-10,7)
18,5% (15,0-22,6)
<0,001
12-18
11,2% (8,1-15,0)
18-24
12,1% (8,4-17,1)
González M. An Pediatr (Barc). 2019
Edad
Prevalencia (probabilidad pretest) % (IC 95%)
Total
Niñas
Niños
3-6 meses
6,6 (1,7-11,5)
5,7 (2,3-9,4)
3,3 (1,3-5,3)
6-12 meses
5,4 (3,4-7,4)
8,3 (3,9-12,7)
1,7 (0,5-2,9)
12-24 meses
4,5 (IC no disponible)
2,1 (1,2-3,6)
<1 (IC no disponible)
<19 años
7,8 (6,6-8,9)
Shaikh N. Pediatr Infect Dis J. 2008.
4
(Tabla) Factores que aumentan el riesgo de desarrollar ITU:
5
(Tabla) Factores de riesgo de desarrollo de cicatrices renales:
6
Rendimiento diagnóstico clínico de ITU
(CP+ = cociente de probabilidad positivo. CP- = cociente de probabilidad negativo. Conviene recordar que CPP
de entre 5 y 10 suponen probabilidad elevada del diagnóstico definitivo de la entidad mientras que
CPP mayores de 10 lo hacen muy probable. Por el contrario, CPN con valores entre 0,10 y 0,20 permiten una
probabilidad elevada de descartar el diagnóstico, y CPN menores de 0,10 presuponen probabilidad muy
alta de excluirlo)
Hallazgo
CP + (IC 95%)
CP – (IC 95%)
Edad <12 meses
1,1 (1,1-0,8)
0,7 (0,6-0,8)
Mujer
1,4 (1,3-0,5)
0,3 (0,2-0,4)
Población no negra
1,2 (1,2-1,3)
0,5 (0,4-0,56)
Fiebre ≥48 horas
1,5 (1,3-0,7)
0,8 (0,7-0,9)
No otra fuente de fiebre
1,6(1,4-1,7)
0,4 (0,3-0,5)
Tª ≥39º C
1,4 (1,3-1,6)
0,6(0,6-0,7)
Orina maloliente
7,4 (3,9-13,9)
0,9 (0,9-1,0)
Historia de ITU
2,6 (1,6-4,3)
1,0 (0,9-1,0)
No circuncidado
4,9 (3,4-7,1)
0,4(0,3-0,6)
Vómitos
1,0 (0,9-1,2)
1,0 (0,9-1,0)
Diarrea
0,9 (0,8-1,1)
1,0 (1,0-1,1)
Dolor abdominal
0,8 (0,3-2,0)
1,0 (1,0-1,0)
Tullus K y Shaikh N. Lancet 2020.
Para el cálculo según combinación de signos y síntomas: University of
Pittsburgh. UTI Calculator 3.0. [Internet]. 2022 [citado 16/07/2022]. Disponible en: https://uticalc.pitt.edu/
7Factores que determinan mayor riesgo de ITU causada por agentes distintos a E. coli son: exposición a antibióticos y hospitalización anterior, lactantes menores de 3 meses, uropatía previa, catéter vesical e inmunodeficiencias.
8Causa más del 80% de los casos.
9Más en varones.
10Otros: Enterobacter, Morganella, Providencia, Citrobacter, Salmonella. Causan en conjunto menos del 10% de los casos
11En el periodo neonatal y en pacientes con malformaciones de la vía urinaria.
12En chicas adolescentes con ITU no complicada.
13Infección de origen hematógeno en recién nacidos y pacientes con neutropenia, nutrición parenteral o tratamiento con corticoides o antibióticos de amplio espectro. La infección ascendente es menos frecuente, salvo en niños con catéter vesical
14Virus patógeno para el tracto urinario. Responsable de cistitis hemorrágicas.
15Sigue
vigente la recomendación de que el diagnóstico de ITU en niños (febril o afebril)
esté condicionado al resultado de un cultivo positivo. Estos parámetros (leucocituria,
nitrituria, bacteriuria, …) nos han de servir para cribar la posibilidad de ITU y para decidir si
iniciamos o no un tratamiento empírico a la espera del resultado del UC. La interpretación del
resultado de la tira reactiva o del examen de la orina en microscopía convencional o automatizada,
debe hacerse de forma individual y siempre en el contexto de la clínica. La capacidad de
predicción del riesgo de padecer ITU de los parámetros analizados se ofrece en la siguiente
tabla. Es preciso aclarar, que estos indicadores pueden modificarse en función del punto de corte que
se haga para las unidades formadoras de colonias exigidas en el UC, así como por la técnica de
recogida de la orina y por la edad de los pacientes. De la versión más reciente de la
Guía NICE (ref) y de la revisión sistemática de Williams sobre pruebas
diagnósticas (ref, 2010) se deducen los siguientes datos:
* Determinación mediante tira reactiva o de laboratorio
Sensibilidad
Especificidad
CP+
CP-
Valor diagnóstico o de exclusión
Leucocituria*,**,***
83%
92%
10,36
0,18
Alto diagnóstico
Alto exclusión
Nitrituria****
37%
99%
29,13
0,64
Alto diagnóstico
Muy pobre exclusión
Leucocitura o nitrituria
92%
92%
11,41
0,09
Alto diagnóstico
Muy alto exclusión
Leucocituria y nitrituria
45%
99%
76,35
0,56
Muy alto diagnóstico
Muy pobre exclusión
Citometría Flujo
Leucocituria
Bacteriuria
Leuco. + bacteriuria
78%
90%
83%
93%
96%
99%
11,50
23,50
83,00
0,23
0,10
0,17
Alto diagnóstico
Pobre exclusión
Muy alto diagnóstico
Muy alto exclusión
Muy alto diagnóstico
Alto exclusión
Microscopia convencional
Leucocituria
Bacteriuria (Tinc. Gram)*****
Leuco. + bacteriuria
74%
91%
86%
96%
5,30
22,30
37,00
0,30
0,09
0,21
Pobre diagnóstico
Pobre exclusión
Muy alto diagnóstico
Muy alto exclusión
Muy alto diagnóstico
Aceptable exclusión
** Mayor grado de predicción según positividad de tira reactiva: trazas o
cualquier cruz de esterasa leucocitaria supondría una CP+ de 4,59 (CP- 0,33); para leucocituria
≥1cruz, el CP+ sería 6,12 (CP- 0,42) mientras que con punto de corte ≥3 cruces el CP+
sería de 22,2 (CP- 0,74). Por microscopía, 5 o más leucocitos por campo CP+ 5,18 (de 10
a 20 CP+ 1,82; de 20 a 50 CP+ 11,18; de 50 a 100 CP+ 15,83; y de 100 a 250 CP+: 47,5)
***Diferentes factores pueden ocasionar falsos negativos al asociarse a escasa
inflamación: Poco tiempo de la orina en la vejiga, infección muy reciente, bacteriuria
asintomática, niños neutropénicos febriles e infecciones por Enterococcus spp,
Klebsiella spp, Pseudomonas aeruginosa.
**** Las infecciones por Pseudomonas aeruginosa, Staphylococcus y cándida,
así como un tiempo corto entre micciones o un pH bajo no dan lugar a elevación de nitritos en
orina.
***** Ausencia de bacterias supone CP+ 0,26; pocas CP+ 1,46; abundantes CP+: 14,04;
cualquier cantidad de bacterias CP+ 2,75.
16Aunque
la realización de una analítica de sangre no es imprescindible para el manejo y tratamiento de
la ITU, sería recomendable su realización (hemograma, bioquímica con marcadores de
función renal, PCR/PCT +/- gasometría con iones) en función de los criterios generales
y/o relativos de ingreso hospitalario. En el resto valorar de forma individual.
Valores de PCT >0,5 ng/mL elevan la probabilidad posprueba de pielonefritis aguda al 84%, y una PCR
<20 mg/mL la disminuye al 20%. Mayor utilidad para el diagnóstico de localización alta de
la ITU si se utilizan de forma combinada (PCR >20 mg/mL, PCT >0,5 ng/mL, Interleukina-6 >4 pg/mL y
alteración de la osmolalidad urinaria máxima). Valores por debajo de los descritos sin
alteración de la osmolaridad urinaria tienen un alto VPN
17En
caso de estar disponible, sería deseable evaluar de modo diferido la función renal
básica en orina (osmolalidad urinaria máxima y albuminuria, entre otros) ya que puede
constituir una ayuda en la toma de decisiones.
Entre los nuevos biomarcadores de infección urinaria, si se desarrollan métodos de
detección rápida, parece que la determinación de lipocalina asociada a gelatinasa de
neutrófilos en orina (uNGAL) o el cociente uNGAL/creatinina podrían ser una de las nuevas
herramientas para el diagnóstico de la ITU.
18Es el
gold estándar en el diagnóstico de ITU, pero el resultado y su interpretación dependen
de la calidad de la muestra recogida y de su adecuada conservación y transporte:
Edad / control esfínteres
Método recogida
Comentarios
Niño mayor, con control de esfínteres
Mitad del chorro miccional limpio
Esmerar la limpieza previa del área genital. En varones retirar el prepucio todo lo
posible
Recuentos superiores a 50 000-100 000 Ufc/ml indican ITU en el 95% de los casos
Recuentos inferiores pueden deberse a: tratamiento antibiótico previo, micción
previa reciente, pH urinario muy bajo, obstrucción ureteral, absceso renal,
gérmenes de crecimiento lento, infección no bacteriana
Lactantes y niños incontinentes
Sondaje vesical, punción suprapúbica
Métodos invasivos recomendados si hay premura por el estado del paciente:
- Orina recogida mediante sondaje uretral (deben considerarse significativos recuentos
superiores a 10 000 Ufc/ml)
- Orina recogida mediante punción suprapúbica guiada por ecógrafo (debe
considerarse significativo cualquier recuento).
Valorar siempre el resultado en el contexto de la clínica
Causas de falsos positivos: mala técnica de recogida, demora en el envío al
laboratorio
Orina al acecho
Sin ser equiparable al chorro miccional limpio, los indicadores de validez podrían
ser asumibles, teniendo en cuenta las limitaciones en atención primaria, donde el
cateterismo no siempre será posible. Considerar cuando pueda permitirse
tiempo de espera
Consiste en recoger la micción espontánea del lactante tras una adecuada
limpieza de genitales
En menores de 6 meses se recomienda realizar estimulación
Recuentos superiores a 50 000-100 000 Ufc/ml indicarían ITU
Bolsa perineal
En general no recomendado (alta tasa de cultivos falsos positivos: bajo VPP). Utilidad
limitada a niños de bajo riesgo, que no necesiten un diagnóstico rápido
y solo para descartar ITU. Si se obtiene un resultado positivo debería
confirmarse con una muestra recogida por un método fiable para UC
19Método microbiológico semicuantitativo que permite obtener un crecimiento en sistemas automáticos de incubación en 3-4 horas con refrigeración de las muestras. Si es positivo la siembra se hace de forma clásica manual para cuantificación final de colonias y caracterización microbiológica en caso de crecimiento significativo. Permite cribar las muestras en las que sería necesario el cultivo.
20En el examen de orina sin centrifugar con objetivo de inmersión, la presencia de 1 microorganismo por campo se correlaciona con un recuento en el UC de más de 105 ufc/ml con una sensibilidad y especificidad mayor del 90%. El interés de la tinción Gram radica en que ofrece un diagnóstico orientativo de microorganismos y puede ayudar a dirigir el tratamiento empírico, sobre todo en urosepsis y en niños de corta edad (si se detecta la presencia de agentes gram positivos, el tratamiento debe incluir un fármaco con actividad frente a Enterococcus o S. agalactiae).
21Su objetivo es detectar anomalías del tracto urinario que puedan predisponer a nuevas infecciones, así como detectar daño renal para prevenir complicaciones a largo plazo. Debe individualizarse la indicación y buscar el equilibrio entre realizar un estudio adecuado y provocar las menores molestias al niño y su familia.
22Es poco sensible para detectar cicatrices renales leves, RVU y PNA. Se recomienda realizar tras 2-6 semanas del episodio de ITU, salvo en pacientes con mala evolución clínica o que requieren ingreso.
23Algunas GPC, no consideran necesario practicar ecografía en niños mayores de 6 meses con una primera ITU febril y buena respuesta al tratamiento, aunque no existe información suficiente para estimar dicho riesgo con precisión.
24Valorar cuando no se disponga de ecografía fetal o postnatal normales realizadas en centro con experiencia.
25Se emplea para detección de obstrucción del tracto urinario inferior y RVU, reservando su indicación para aquellas situaciones con mayor riesgo de asociar RVU de alto grado. En caso de estar disponible, la ecocistografía es la técnica con mayores ventajas.
26Alteraciones sugestivas en la ecografía (salvo ectasia aislada) o en la gammagrafía renal (salvo defectos leves sin afectación de la función renal relativa).
27El uso de pruebas básicas de función renal en orina (osmolalidad urinaria máxima y albuminuria, entre otros) puede ayudar en la toma de decisiones.
28Empleada para el diagnóstico de PNA en fase aguda o nefropatía cicatricial en fase tardía (> 6-12 meses tras la ITU). No se recomienda su realización rutinaria en fase aguda, valorando su indicación diferida en situaciones de mayor riesgo de daño renal.
29Alteraciones previas en ecografía (hipodisplasia), cistografía (RVU de alto grado) o gammagrafía en fase aguda, en caso de haberse realizado.
30HTA, retraso de crecimiento o alteración de la función renal.
31La decisión de ingresar o no un niño con ITU para antibioticoterapia intravenosa no debe sustentarse de forma exclusiva en la presencia de fiebre o en los resultados de parámetros analíticos sugerentes de PNA. No obstante, dichos parámetros deben ser tenidos en cuenta a la hora de valorar la posible repercusión sistémica de la ITU y el riesgo de alteración de la función renal
32En los próximos años, es probable que pacientes seleccionados puedan también beneficiarse de la hospitalización domiciliaria pediátrica, que ya es una realidad en algunos centros de nuestro país
33Por el riesgo de bacteriemia y sepsis. Sin embargo, en lactantes sanos entre 16 y 90 días, con buen estado general, sin elevación de reactantes de fase aguda, bacilos gramnegativos en orina y posibilidad de seguimiento estrecho, se podría valorar tratamiento ambulatorio secuencial (parenteral 48-72 horas seguido de oral).
34Uropatía obstructiva, RVU dilatado (III-V) y displasia renal bilateral. Considerar en pacientes con riñón único.
35Podría considerarse el ingreso hospitalario en los niños con infección urinaria febril si presentan varios de los siguientes factores, por su posible asociación con daño renal y/o RVU de alto grado. En pacientes con criterios relativos de ingreso y posibilidad de seguimiento adecuado, podría también valorarse tratamiento secuencial ambulatorio, iniciando ceftriaxona o aminoglucósido durante 48-72 horas previo a antibioticoterapia oral.
36Los criterios de derivación se basan en la necesidad de seguimiento de pacientes que asocian una alteración nefrourológica o daño renal, o cuando se requiera su diagnóstico en situaciones de mayor riesgo o realizar pruebas complementarias no disponibles en Atención Primaria.
37RVU dilatado (grado III-V) y otras anomalías estructurales detectadas tras la ITU, incluyendo los pacientes con riñón único.
38Trastornos miccionales que no responden a la uroterapia estándar o asociados a RVU y/o anomalías de la región dorsolumbar.
39Daño renal confirmado en estudios de imagen o mediante marcadores en sangre (urea, creatinina, cistatina C) o en orina (proteinuria u alteración de la osmolalidad máxima urinaria).
40Habitualmente, en niños con tracto urinario normal y tras presentar una primera ITU febril no complicada, se recomienda el seguimiento clínico de los pacientes durante el primer año de evolución, instaurando medidas generales de prevención e informando de la necesidad de un diagnóstico y tratamiento precoces en futuros episodios.
41Todo niño con el diagnóstico presuntivo de ITU febril debe ser tratado precozmente con antimicrobianos de forma empírica una vez recogida muestra para cultivo mediante una técnica adecuada. Menos relevante en el caso de ITU afebril en > 1-2 años. Una vez conocidos los resultados de los UC y antibiograma, ajustar el tratamiento a favor del antimicrobiano de menor espectro y mejor perfil de tolerabilidad y seguridad.
42Las ITU febriles con buen estado general, sin antecedentes de nefro/uropatía y con acceso a control y vigilancia médica, son, en general, subsidiarias de tratamiento ambulatorio con un antibiótico oral. Duración del tratamiento 7-10 días y antibióticos que alcancen concentraciones altas en el parénquima renal.
43La sensibilidad de E. coli puede variar ampliamente. El tratamiento inicial deberá ajustarse a las características individuales del paciente y al perfil de sensibilidad de los agentes prevalentes en el entorno asistencial. Se ha comprobado un incremento sustancial, aunque con amplias variaciones, de la tasa de cepas de E. coli resistentes a ampicilina, cotrimoxazol, cefalosporinas de primera generación y amoxicilina/clavulánico.
44Antibioterapia inicialmente parenteral. Tras 3-4 días y mejoría clínica clara puede considerarse el tratamiento ambulatorio secuencial de modo individualizado, incluso en lactantes menores de 3 meses (16-90 días). Elegir el antimicrobiano según el antibiograma para continuar con el tratamiento oral
45Ampicilina es necesaria para cubrir Enterococcus y S. agalactiae presente en un pequeño porcentaje de lactantes menores de 1-2 meses de edad y Enteroccoccus en mayores de esa edad en pacientes con antecedentes de malformaciones urológicas.
46Algunos expertos cuestionan la jerarquización aminoglucósido/1ª elección, cefotaxima/alternativa, por el mayor riesgo de toxicidad del primero y de la mejor difusión de la cefotaxima en SNC en caso de meningitis concomitante. En caso de sospecha de sepsis/meningitis se usarán dosis altas. Por el contrario, hay que tener en cuenta, por un lado, la posibilidad de colonización previa por bacterias productoras de BLEE o gérmenes atípicos y, por otro, la inducción de resistencias que presentan las cefalosporinas por un uso abusivo. En cualquier caso, siempre se seleccionará en sustitución de los aminoglucósidos en niños con nefropatía o función renal comprometida.
47Si se selecciona aminoglucósido: 1) Hacer previamente una comprobación de la función renal. 2) Considerar que una dosis diaria es eficaz y menos nefrotóxica. 3) Valorar, si es necesario, el aminoglucósido con menor perfil de resistencias y de menor perfil nefrotóxico: amikacina menor que tobramicina, ambos menor que gentamicina.
48No usar ceftriaxona en pacientes con hiperbilirrubinemia.
49Tasas de resistencia crecientes. Evitar en áreas con tasas de resistencia igual o mayor del 10-15%.
50Por vía IV se puede usar, según ficha técnica, desde el nacimiento. Por vía oral solo para >3 meses. Tener en cuenta su peor difusión al parénquima renal que otras cefalosporinas, por lo que se deben usar dosis mayores ante probable PNA (ITU febril o afebril en menores de 1-2 años).
51En zonas con alto nivel de resistencias o con factores de resistencia añadidos (enterobacterias distintas a E. coli, Pseudomonas spp, Enterococcus o S. aureus), pacientes con colonización previa por bacterias productoras de BLEE o con probabilidad de infección por gérmenes no habituales (antibióticoterapia u hospitalización reciente, uso de profilaxis antibiótica, malformación de la vía urinaria, cateterismo, inmunodeficiencia).
52Aprobado por la AEMPS para infecciones complicadas de las vías urinarias y pielonefritis, por la FDA para el tratamiento de segunda línea de las ITU complicadas, ITU por P. aeruginosa/BGN multirresistentes a múltiples fármacos en mayores de 1 año. Sería recomendable iniciarlo de forma dirigida, con resultado del UC.
53Si sospecha de patógenos que así lo requieran, por ejemplo, si alta probabilidad de enterobacteria productora de BLEE y no se pueda dar amikacina o tratamiento dirigido con el resultado del UC.
54Para el tratamiento oral desde el inicio o tras la mejoría con tratamiento parenteral inicial.
55Si hay factores de riesgo o sospecha de infección por enterococo usar de primera elección.
56Mayores de 12 años de edad.
57La ficha técnica de esta formulación ha sido recientemente modificada por la AEMPS, retirando de sus indicaciones a niños menores de 12 años. Sin embargo, dada el adecuado espectro antibacteriano, su sensibilidad frente a los uropatógenos más frecuentes de las ITU y el amplio uso en población infantil hasta la fecha, se puede considerar una alternativa adecuada en niños. Se debe informar a las familias de que es un uso off-label.
58Salvo elevada sospecha clínica en lactantes con fiebre sin otro foco infeccioso y/o elevada sospecha clínica en pacientes con uropatía.
59Valorar la monitorización de niveles a partir de las 48 horas y ajuste de dosis en base a los resultados.
60La dosis máxima se calcula en función de los niveles plasmáticos, determinando los niveles pico y valle siempre que sea posible. La posología no debe exceder los 5 mg/kg/día, a menos que los niveles séricos se supervisen para prevenir un aumento de la toxicidad debido a niveles sanguíneos excesivos.
61No siempre previene la recurrencia de ITU, asociando alta tasa de resistencias en ITU posteriores y sin modificar, habitualmente, la aparición de nuevo daño renal o su gravedad. Se optaría por el antibiótico de menor espectro posible, como trimetoprim o cotrimoxazol, utilizando una dosis nocturna equivalente el 25% de la dosis terapéutica. En menores de 2-3 meses, usar amoxicilina, cefalosporinas de 1ª generación o amoxicilina-clavulánico.
62El riesgo de ITU es mayor en la uropatía obstructiva baja, a nivel de la unión ureterovesical, y en los pacientes con hidronefrosis de alto grado (grado 3-4).
63Los pacientes de mayor riesgo de daño renal son aquellos que asocian micción disfuncional y las niñas con RVU dilatado (III-V).
64Valorar de modo individualizado en pacientes sin uropatía pero con ITU recurrente, tras estudio pertinente que descarte alteraciones estructurales o funcionales, como la micción disfuncional.
65No se recomienda el uso sistemático de profilaxis previo a la realización de procedimientos que requieren sondaje vesical aislado, aunque el riesgo de ITU es mayor en aquellos pacientes con patología malformativa de la vía urinaria, por lo que actualmente en un escenario de indicación selectiva de pruebas invasivas a pacientes de alto riesgo, podría administrarse una pauta de tratamiento antibiótico de 3 días, realizando la cistografía el segundo día.
66Aunque la presencia de fimosis podría favorecer el desarrollo de ITU, en nuestro medio es excepcional que se recomiende tratamiento quirúrgico en ITU de repetición (NNT para prevenir 1 episodio de ITU en población general: 111; en varones con RVU de alto grado: 4).
67La micción disfuncional está presente en el 30-50% de los niños con ITU y se relaciona con ITU recurrente, daño renal (OR 6,4, 95% CI 2,9-14,4) y persistencia del RVU.
68La duración y dosificación del extracto de arándano rojo está por clarificar por la concentración variable de las proantocianidinas (principio activo).
| Notas: la Guía-ABE se actualiza periódicamente. Los autores y editores recomiendan aplicar estas recomendaciones con sentido crítico en función de la experiencia del médico, de los condicionantes de cada paciente y del entorno asistencial concreto; así mismo se aconseja consultar también otras fuentes para minimizar la probabilidad de errores. Texto dirigido exclusivamente a profesionales. | |||
|
[i] Más información en:
http://www.guia-abe.es/
[*] Comentarios y sugerencias en: laguiaabe@gmail.com |
Novedades
- Vulvovaginitis
- Pediculosis de la cabeza
- Bronquiolitis
- Gripe. Pruebas para la detección rápida del virus
- Malaria
 Tema nuevo
Tema nuevo  Tema actualizado
Tema actualizado Lo más leído
- Infecciones de la piel y partes blandas (I): impétigo, celulitis, absceso
- Balanitis
- Gastroenteritis aguda
- Faringitis aguda
- Orquiepididimitis aguda








