
Tuberculosis
Fecha de actualización: 14/02/2025
(V.3.0/2025)
Epidemiología
- La tuberculosis (TB) es la enfermedad causada por Mycobacterium tuberculosis complex, que comprende M. tuberculosis, M. bovis y M. africanum, M. canetti y M. microti.
- Según la OMS, en 2023, el 12% de los casos nuevos de TB en el mundo se produjeron en menores de 15 años; en Europa fue el 3.6% de los casos diagnosticados. En España, en 2023, la incidencia de TB en adultos fue 8.2 casos por 100 000 habitantes (3.944 casos); en la población pediátrica la incidencia fue 5.3 casos por cada 100.000 menores de 15 años. Tras la pandemia del COVID-19 ha tenido lugar un enlentecimiento de la tendencia decreciente observada desde 2015, debido a la falta de estudio de contactos, retrasos diagnósticos y a la mayor transmisión durante en confinamiento. No obstante, la incidencia se mantiene por debajo de niveles pre-pandémicos. Respecto a co-infección con VIH, en 2023 se declararon 229 casos de coinfección TB-VIH (5.8 % del total de casos notificados). En un estudio realizado por las cohortes pediátricas nacionales Corispe y pTBred, se encontró que, entre 2000 y 2016, un 2.4% de los niños con VIH en España presentaron coinfección VIH.
- La TB en el niño se considera un evento centinela que indica transmisión reciente en una comunidad desde un adulto bacilífero. La población infantil conforma un grupo especialmente vulnerable. No todos los individuos expuestos desarrollan enfermedad, pero la tasa es más elevada a menor edad del paciente1: 40-50% de los menores de 12 meses, 24% de los de 1-5 años y un 15% de los adolescentes la desarrollarán en 1-2 años (fundamentalmente en los primeros 6 meses tras la infección). Además, a menor edad, mayor riesgo de desarrollo de TB extrapulmonar y formas diseminadas. Si no se tratan, los niños infectados representan el reservorio de la enfermedad futura.
- El Plan Nacional para el Control de la Tuberculosis publicado en el año 2019 recomienda realizar
despistaje de infección TB en las personas con mayor riesgo de progresión de la
enfermedad:
- Contactos con un paciente con enfermedad tuberculosa.
- Personas con infección por el VIH
- Personas en las siguientes circunstancias: inicio de terapias biológicas o inmunosupresoras, diálisis, candidatos a trasplante de órganos o progenitores hematopoyéticos.
- Valorar en menores que hayan viajado a países de alta incidencia y hayan estado expuestos, a las 10 semanas del regreso, migrantes de estos países o en proceso de adopción.
Clínica
- Las manifestaciones clínicas dependen del inóculo, su virulencia, del estado inmunitario y nutricional del huésped y de la existencia de otras enfermedades. No hay una forma clínica específica de la TB infantil. La mayoría de los niños con enfermedad TB están asintomáticos o presentan síntomas inespecíficos (fiebre, astenia, anorexia, sudoración nocturna, artralgias). En otras ocasiones hay fiebre prolongada o síntomas de enfermedad pulmonar como dificultad respiratoria, tos, dolor torácico, expectoración y raramente hemoptisis.
- En España, un 60% de los niños tienen formas de TB no graves, que pueden beneficiarse de pautas cortas de tratamiento.
Diagnóstico
- Todos los niños en contacto con un caso de TB bacilífera deberán ser estudiados y clasificados en expuestos, infectados o enfermos.
- El diagnóstico de certeza de la TB pulmonar requiere la identificación microbiológica mediante técnicas moleculares o cultivo en muestra respiratoria (jugo gástrico, esputo espontáneo o inducido, heces). En el 40-50% de los casos, el diagnóstico será clínico, basado en la epidemiología, las pruebas inmunológicas in vivo (prueba de tuberculina -PT- o Mantoux) o in vitro (Interferon Gamma Releas Assay - IGRA), los síntomas clínicos, y los hallazgos radiológicos, además de la anatomía patológica, cuando se disponga.
- El Plan Nacional 2019 recomienda realizar el despistaje de infección por VIH ante el diagnóstico de TB, y el de TB ante un caso de infección por VIH.
- Ante un diagnóstico de TB, no hay que olvidar declarar el caso, ya que es una Enfermedad de Declaración Obligatoria.
Tratamiento
- Los contactos expuestos no infectados menores de 5 años o inmunodeprimidos deben recibir isoniazida de forma profiláctica durante 8-12 semanas, hasta repetir Mantoux y/o IGRA. Los mayores de 5 años inmunocompetentes no precisan profilaxis hasta repetir Mantoux y/o IGRA a las 8-12 semanas.
- Existen varias opciones para el tratamiento de la infección TB: isoniazida + rifampicina 3 meses, rifampicina 4 meses, isoniazida 6 meses, isoniazida 9 meses. Todas las opciones se consideran válidas, debiendo individualizar en cada paciente, con preferencia por pautas cortas para favorecer la adherencia.
- Nueva pauta corta de 4 meses para el tratamiento de enfermedad TB: 2 meses isoniazida + rifampicina + pirazinamida ± etambutol (HRZ ± E) (fase intensiva) + 2 meses isoniazida + rifampicina (HR) (mantenimiento). Requisitos: edad 3 meses - 16 años (se excluyen prematuros, lactantes <3 kg de peso y embarazadas), enfermedad no grave (TB pulmonar caracterizada por linfadenopatía mediastínica sin obstrucción de vía aérea, afectación pulmonar no cavitada, limitada a un lóbulo pulmonar, sin patrón miliar, con/sin derrame pleural no complicado así como TB ganglionar periférica no complicada), baciloscopia negativa, cepa sensible o presumiblemente sensible a fármacos de primera línea.
- Pauta tradicional 6 meses en el resto de casos: 2 meses HRZ ± E (intensiva), 4 meses HR (mantenimiento).
- El tratamiento de TB resistente, o grave, pacientes inmunocomprometidos o niños pequeños debe llevarse a cabo en un centro con experiencia.
|
Formas clínicas de enfermedad TB |
|
|
TB intratorácicas |
|
|
TB extratorácicas |
|
|
TB congénita |
TB confirmada microbiológicamente en el recién nacido o lactante (por cultivo o PCR) y al menos una de las siguientes condiciones (Criterios de Cantwell)
|
|
Consideración de gravedad |
|
|
Enfermedad no grave |
|
|
Enfermedad grave |
|
|
Situaciones clínicas que pueden dar lugar a la sospecha inicial de TB en el niño |
|
|
Estadios en la historia natural de la TB |
|
|
Exposición a TB sin evidencia de Infección |
|
|
Infección TB (antes infección TB latente) |
|
|
Enfermedad TB
|
|
|
Estudios complementarios |
||
|
|
Indicados en la evaluación inicial |
Indicados en situaciones especiales |
|
Laboratorio |
Hemograma y bioquímica básica2 |
Adenosin-deaminasa (ADA): valores significativos son >40 U/L en líquido pleural y >4 U/L en líquido cefalorraquídeo |
|
Punción lumbar |
Algunos expertos recomiendan punción lumbar diagnóstica en menores de 12 meses con TB pulmonar o extrapulmonar, aun sin síntomas neurológicos |
|
|
Pruebas Inmunológicas |
|
|
|
Microbiología3 |
Si sospecha de enfermedad TB (clínica y/o radiografía compatibles),
|
Si se confirma enfermedad TB:
|
|
Imagen |
Rx de tórax (dos proyecciones)5 |
|
|
Prueba de la tuberculina (PT) o Mantoux |
|
|
|
|
Técnica |
La lectura registra en milímetros (mm) la induración mediante palpación, medida en el eje transversal al eje mayor del antebrazo, y debe realizarse a las 72 horas de la inyección (válido 48-96 horas). Puede haber falsos positivos y negativos. |
|
Interpretación |
|
|
Observaciones |
|
|
Falsos positivos |
|
|
Falsos negativos |
|
|
IGRA (Interferón Gamma Release Assays) |
|
|
Recomendaciones para el uso de PT/IGRA |
|
|
Indicaciones de ingreso hospitalario |
|
|
Tratamiento en la enfermedad TB. Pauta clásica |
||
|
Fase |
De elección |
Alternativas |
|
Inicial (2 meses): HRZ ± E (Fase de inducción o bactericida) |
|
|
|
Continuación (4 meses mínimo): HR (Fase de mantenimiento) |
|
|
|
||
|
Tratamiento en la enfermedad tuberculosa. Otras pautas |
|
|
Régimen corto 4 meses
|
Requisitos:
|
|
Régimen en paciente con VIH Si el paciente no ha comenzado el TAR, se recomienda su inicio precoz en las 2 semanas posteriores tras el inicio de tratamiento antituberculoso. |
Régimen corto. En niños y adolescentes con TB no grave, dependiendo del grado de inmunosupresión y del estado de la terapia antirretroviral (TAR), así como de la presencia de otras infecciones oportunistas, puede beneficiarse de un régimen corto: Cuatro meses, vigilados de cerca y ampliar a 6 meses en caso de dudas sobre su evolución. Régimen largo. La duración se prolonga a 9 meses en caso de:
|
|
Regímenes clásico 6 meses |
Niños menores de 3 meses de edad. Los niños y adolescentes que han recibido tratamiento para la TB en los dos años anteriores deben ser tratados con régimen estándar: 2 HRZE/4HR. |
|
Efectos adversos y toxicidad de los fármacos antituberculosos |
|
|
Fármacos |
Efectos adversos/Toxicidad |
|
Isoniazida |
Hepatitis, polineuropatía periférica y convulsiones, hipersensibilidad |
|
Rifampicina |
Intolerancia gastrointestinal (GI), artralgias, síndrome gripal, hepatitis, nefritis intersticial, secreciones anaranjadas, prurito, trombocitopenia, interfiere con anticonceptivos orales. Interacciona con algunos fármacos de la TAR, como los inhibidores de la proteasa. |
|
Pirazinamida |
Hiperuricemia, hepatitis, intolerancia GI, artralgias, prurito, fotosensibilidad |
|
Etambutol |
Neuritis óptica, alteración de la percepción de colores, hipersensibilidad |
|
Estreptomicina |
Ototoxicidad, nefritis intersticial, hipersensibilidad |
|
Otras medidas terapéuticas y de prevención |
|
|
Tratamiento de la infección TB |
|
|
De elección |
Alternativas |
|
Opciones válidas:
ó
ó
En pacientes con origen en países endémicos de hepatitis virales, VIH o esquistosomiasis deben descartarse estas enfermedades antes de iniciar tratamiento. |
Las pautas intermitentes (Isoniacida: 15 mg/kg/día, 9 meses, 2-3 veces por semana) solo deberían indicarse en problemas de adherencia y siempre bajo TDO En intolerancia a H o exposición a caso de resistencia a la H o sospecha de ésta: rifampicina 15 (rango 10-20) mg/kg/día (máximo 600 mg/día), 4 meses, una vez al día; o en TDO 15 mg/kg/día, 3 veces por semana Si exposición a cepa multirresistente (a H y R): no hay datos con suficiente evidencia en niños, se recomienda derivar a centro especializado. Otras opciones: H + rifapentina semanal (12 semanas en ≥12 años FDA- no comercializado en España); H+R+P 2 meses. No se recomienda R+Z durante 2 meses por aumento del riesgo de hepatotoxicidad. |
|
Profilaxis primaria o postexposición12 |
En el paciente inmunocompetente mayor de 5 años no se recomienda profilaxis post-exposición. (Ver algoritmo más adelante) |
|
Tratamiento de la TB congénita13 |
|
De elección: asociar 4 fármacos de primera línea durante 2 meses: HRZ, y como cuarto fármaco amikacina en caso de enfermedad grave o diseminada; podría ser E en caso de enfermedad no grave. En la fase de mantenimiento se combinan H y R a dosis habituales, si adecuada evolución clínica y no resistencias en el paciente o en caso índice. |
|
Tratamiento de la TB durante el embarazo y la lactancia |
|
|
Tratamiento-abordaje del recién nacido cuya madre tiene infección ó enfermedad TB |
|
|
Madre con Mantoux (+), asintomática y Rx normal |
|
|
Madre con Mantoux (+) y Rx alterada: enfermedad TB |
|
|
Tratamiento quirúrgico |
|
Se considerará en los siguientes casos:
|
|
Definiciones TB resistente |
|
|
|
|
Tratamiento de la TB mono-resistente |
|
|
TB mono-resistente a H: 6 meses R, Z, E y levofloxacino, con o sin H. |
|
|
Tratamiento de la TB MDR |
|
|
Duración
|
|
|
Fases
|
|
|
Fármacos antiTB |
|
|
Esquema de tratamiento |
1) Todos los fármacos posibles del Grupo A 2) Al menos un fármaco del grupo B. 3) Añadir fármacos del grupo C si preciso 4) Si sensibilidad, añadir etambutol y pirazinamida. |
| Algoritmo de diagnóstico de la TB |
| Contacto con paciente con TB activa |
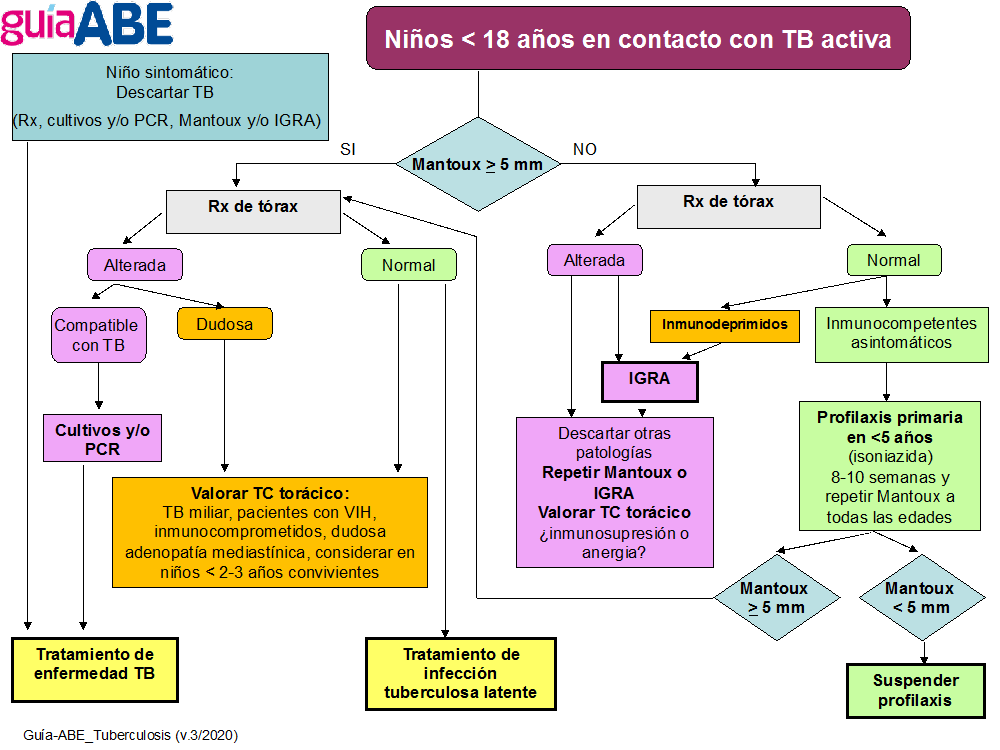
|
| Referencias bibliográficas |
|
Abreviaturas: AAP: American Academy of Pediatrics. ADA: adenosine deaminase activity. BCG: vacuna de Calmette-Guerin. CDC: Centers of Diseases Control and Prevention, USA. E: etambutol. H: isoniacida. HRZ: isoniacida + rifampicina + pirazMDRinamida. IGRA: inmunodiagnóstico por Interferón Gamma -IFN-γ- Release Assay (Quantiferon-TB Gold o T-SPOT-TB). IM: vía intramuscular. ITB: infección tuberculosa. IV: vía intravenosa. LCR: líquido cefalorraquídeo. MDR: multi-resistente. PCR: reacción en cadena de la polimerasa. R: rifampicina. Rx: radiografía. TB: tuberculosis. TC: tomogr-afía computarizada. TDO: tratamiento directamente observado. VIH: virus de la inmunodeficiencia humana. VO: vía oral. XDR: extremadamente resistente. Z: pirazinamida.
1Otros factores de riesgo importantes son: infección reciente (últimos 2 años), inmunodeficiencia incluido VIH, tratamiento inmunosupresor como uso prolongado de corticoides o ciertas terapias biológicas.
2Conviene tener al menos una determinación inicial de hemograma y función hepática si se va a prescribir tratamiento farmacológico, especialmente en pacientes con enfermedad hepática subyacente. Puede haber anemia, leucocitosis, PCR y VSG elevadas, pero son inespecíficas.
3El aislamiento
de la micobacteria, tras obtener la muestra por medio de aspirado de jugo gástrico o de esputo
(espontáneo o inducido con aerosol de suero salino al 3%) será por:
4Actualmente se recomienda realizar siempre estudio de resistencia a tuberculostáticos, excepto en el caso de tenerlo realizado en el contacto. Si hay cepas resistentes a algún fármaco de primera línea, se recomienda un estudio de sensibilidad a fármacos de segunda línea, y estudio genético, aunque no sean multirresistentes.
5Radiología de tórax. Hallazgos: Infiltrados, condensaciones, nódulos, cavitaciones, retracciones fibrosas, calcificaciones, adenopatías y atelectasias segmentarias. No existen signos patognomónicos, pero se debe pensar en la posibilidad de TB pulmonar ante la presencia de adenopatías o la combinación de infiltrados parenquimatosos y cambios mecánicos inducidos por la compresión de la vía aérea por adenopatías. Hasta un 10% de los niños con TB pulmonar confirmada pueden presentar una imagen radiológica convencional normal. Los adolescentes pueden mostrar hallazgos radiológicos de adultos, o bien de niños menores de 10 años de edad.
6Los niños menores de 2 o 3 años merecen una atención especial ya que en ellos el estado de infección latente podría ser más ficticia que real, y es más probable que tengan ya la enfermedad aunque estén asintomáticos. En este grupo de edad con prueba tuberculínica positiva y radiología normal, algunos autores indican la realización de una TC de tórax, aunque no existe consenso uniforme. Habría que tener en cuenta la radiación que implica la TC, y la necesidad de sedación en muchos casos. Tampoco existe actualmente consenso para definir qué se considera adenopatía (probablemente >1 cm), ni si el tratamiento con 3 fármacos mejoraría la evolución de estos niños dada la baja carga bacilar existente en estos casos. Otras indicaciones de TC pueden verse en otras partes del texto (inmunodeprimidos, complicaciones…).
7La ecografía mediastínica puede ayudar en el diagnóstico de TB mediante la detección de adenopatías (patológicas si son mayores de 10 mm o bien mayores de 5 mm localizadas en varios compartimentos); no obstante, su uso no está incluido actualmente en las guías clínicas. También detecta y cuantifica la presencia de derrame pleural y pericárdico y permite la valoración de adenopatías abdominales que son frecuentes en pacientes con TB y VIH. Además, se ha utilizado para monitorizar la evolución de la TB con el tratamiento.
8Meningitis
tuberculosa. Es la complicación más grave de la TB, pues puede ser mortal o dejar graves
secuelas si no se trata adecuadamente. La máxima incidencia ocurre en menores de 3-4 años.
Se suele producir tras primoinfección TB y puede encontrarse afectación pulmonar hasta en
un 75% de los casos. Clásicamente al inicio cursa con síntomas insidiosos e
inespecíficos. Posteriormente, y de forma progresiva, aparece clínica de
meningo-encefalitis: cambio de carácter, síntomas de inicio de hipertensión
intracraneal, meningismo, cefalea, irritabilidad, parálisis de pares craneales, convulsiones,
alteración del nivel de conciencia, focalidad, etc. Existen 3 estadíos.
Hallazgos en
el LCR sugestivos: células de 10 a 500, predominio linfocitos (en raras ocasiones predominio de
polimorfonucleares inicialmente), hiperproteinorraquia (1-3 g/l), hipoglucorraquia (típico <40
mg/dl; raro <20 mg/dl). ADA elevado (normal hasta 4 U/L). Sospechar TB si LCR aparentemente
compatible con infección por virus, pero con glucosa baja o proteínas demasiado
altas.
9TB en niños infectados por VIH. Suele ser más graves y progresiva, y es más probable que existan lesiones extrapulmonares. La radiología torácica es similar a las de los niños con inmunidad normal, pero hay más tendencia a extensión lobar y cavitación. En pacientes adultos con TB e infección por VIH se debe administrar el tratamiento antirretroviral cuanto antes, dentro de las 8 semanas del inicio de tratamiento antiTB. El momento óptimo depende del recuento de células CD4+: lo antes posible si es <50 células/mcl, y puede retrasarse si es >50 hasta finalizar la fase intensiva del tratamiento antiTB.
10Existe un programa de Coordinación de Adherencia terapéutica de la Comunidad de Madrid y Cruz Roja (https://www.comunidad.madrid/sites/default/files/doc/sanidad/epid/procedimiento_derivacion_cruz_roja_sgvsp_2023.pdf) para implementar el TDO: tfno 600 56 78 40 – 91 532 55 55 Ext 52066 e-mail: tbc-vih@cruzroja.es
11La mayoría de expertos recomiendan usar H salvo que el aislamiento del caso índice sea resistente a la misma.
12 La OMS, la SEIP y la AEP desde 2017 recomiendan la profilaxis en expuestos menores de 5 años de edad, ya no en todos los menores de 18 años como era previamente. En niños inmunocomprometidos probablemente debería realizarse la profilaxis un total de 9 meses independientemente del resultado del Mantoux a las 8-12 semanas. En niños inmunocompetentes de 5 años o más, se repetirá el Mantoux, si es negativo, y no hay datos de que pueda ser un falso negativo, se excluirá infección; y si es positivo, se tratará como una ITBL.
13La TB congénita es rara. Si se sospecha que un recién nacido puede tener TB congénita habría que realizar lo antes posible: Mantoux (normalmente negativo hasta los 3-4 meses)/IGRA, Rx tórax, fondo de ojo, ecografía abdominal y cerebral, punción lumbar y los cultivos apropiados, incluido 3 aspirados gástricos. Independientemente del Mantoux, se debería iniciar tratamiento lo antes posible. Si es posible, habría que analizar la placenta histológicamente y cultivarla para M. tuberculosis.
14No se ha establecido la seguridad de la pirazinamida durante el embarazo, aunque muchos expertos la recomiendan, ya que no se ha objetivado daño en el feto en los casos utilizados. H, R y etambutol son relativamente seguras para el feto. Debe evitarse estreptomicina ya que puede producir ototoxicidad en el feto. H se excreta en la leche, pero no se han descrito efectos adversos en el lactante.
15En España todas las presentaciones de H en la actualidad combinan piridoxina en su presentación.
16Administrar siempre tras comprobar que el Mantoux es negativo (en menores de 2 meses, además que no tienen TB congénita), y son VIH negativos. La vacuna BCG en raras ocasiones puede producir efectos secundarios que normalmente no son importantes, como absceso subcutáneo o adenopatía regional.
| Notas: la Guía-ABE se actualiza periódicamente. Los autores y editores recomiendan aplicar estas recomendaciones con sentido crítico en función de la experiencia del médico, de los condicionantes de cada paciente y del entorno asistencial concreto; así mismo se aconseja consultar también otras fuentes para minimizar la probabilidad de errores. Texto dirigido exclusivamente a profesionales. | |||
|
[i] Más información en:
http://www.guia-abe.es/
[*] Comentarios y sugerencias en: laguiaabe@gmail.com |
Novedades
- Vulvovaginitis
- Pediculosis de la cabeza
- Bronquiolitis
- Gripe. Pruebas para la detección rápida del virus
- Malaria
 Tema nuevo
Tema nuevo  Tema actualizado
Tema actualizado Lo más leído
- Infecciones de la piel y partes blandas (I): impétigo, celulitis, absceso
- Balanitis
- Gastroenteritis aguda
- Faringitis aguda
- Orquiepididimitis aguda








