Nos interesa su opinión, ¡Realice nuestro Cuestionario de satisfacción Guía ABE! |

Lectura interpretada del antibiograma
Fecha de actualización: 20/06/2021
(V.1.0/2021)
- El objetivo de un antibiograma es evaluar in vitro a respuesta de un microorganismo a uno o varios antimicrobianos, sirviendo en una primera aproximación como factor predictivo de su eficacia clínica.
- La CMI de un microorganismo ante un determinado antibiótico es la concentración mínima de ese antibiótico necesaria para inhibir su crecimiento en condiciones normalizadas. No se trata de un valor absoluto y no es comparable entre distintos antibióticos y/o microorganismos; por tanto, su mayor o menor valor con respecto a la CMI de otro antimicrobiano carece de valor como dato para guiarnos en la elección del tratamiento antibiótico dirigido.
- La interpretación de un antibiograma es la categorización clínica del microorganismo en SENSIBLE, INTERMEDIO (SENSIBLE CUANDO SE INCREMENTA LA EXPOSICIÓN) o RESISTENTE. Ésta nos va a informar de las posibilidades de éxito terapéutico con el antimicrobiano utilizado en su dosis habitual o incrementada.1
- La lectura interpretada del antibiograma consiste en el análisis del patrón de sensibilidades para así intentar predecir los mecanismos de resistencia que pudieran estar presentes. Conocer éstos nos permitirá por un lado deducir la sensibilidad a algunos antibióticos no probados, así como en su caso la recategorización clínica de algunos otros2.
- Para realizar la lectura interpretada del antibiograma es necesario conocer el espectro de los antimicrobianos, ciertas características farmacocinéticas y farmacodinámicas y su relación, así como los principales mecanismos de resistencia a los antimicrobianos.
- Clásicamente su finalidad ha sido tanto clínica como epidemiológica. En la práctica clínica, guiándonos en la elección del antimicrobiano más acertado, permitiéndonos bien una optimización del uso de antimicrobianos con respecto a la elección empírica (realizando una terapia dirigida con un antibiótico activo frente a ese microorganismo pero de menor espectro y/o toxicidad) bien una terapia secuencial (completando vía oral un tratamiento iniciado de forma parenteral). En el ámbito epidemiológico, en el control de infecciones por bacterias resistentes y el establecimiento de políticas de antimicrobianos, si bien en la actualidad los métodos de estudio genómico están comenzando a reemplazar a la interpretación fenotípica en este último campo.
- Conocer los principales fenotipos de resistencia de las bacterias más comunes en la práctica clínica nos va a resultar de utilidad a la hora de elegir de forma empírica el antimicrobiano así como su dosis más adecuada, resultando en unas mayores probabilidades de éxito terapéutico y una disminución en la selección de resistencias.
- Ante las dudas en la interpretación del antibiograma, se debe consultar con el infectólogo o el microbiólogo para optimizar el tratamiento antimicrobiano.
* Puntos a considerar ante un antibiograma
|
MÉTODOS DE DETERMINACIÓN DE RESISTENCIA (fenotípicos: determinación de CMI) |
||
|
MÉTODOS DE DIFUSIÓN |
||
|
Antibiograma disco-placa |
Discos de papel secante impregnados con el antibiótico colocados sobre la superficie del agar en una placa de Petri en la que previamente se ha inoculado el microorganismo. El antibiótico difunde hacia el agar y se crean gradientes de concentración. El crecimiento bacteriano quedará inhibido con una determinada concentración de antimicrobiano, es decir, a una determinada distancia del disco. |
Según la longitud de este diámetro de inhición (datos estandarizados mediante estudios comparativos de este método con otros que determinan CMI) se categoriza al microorganismo como sensible, sensible aumentando la dosis o resistente al antibiótico probado. VENTAJAS: versátil, sencillo y económico. DESVENTAJAS: no permite una lectura directa de la CMI. |
|
Tira de gradiente de CMI (Épsilon o E-test) |
Tira de plástico no poroso o papel con un gradiente predefinido del antibiótico. El antibiótico difunde hacia el agar creándose a lo largo de la tira un gradiente exponencial de concentraciones. El crecimiento bacteriano quedará inhibido con una determinada concentración de antimicrobiano, es decir, a una determinada altura de la tira. |
El valor de la CMI quedará determinado a la altura del halo de inhibición. VENTAJAS: método sencillo de medición directa, bien correlacionado con el gold standard (dilución en agar). DESVENTAJAS: caro. |
|
MÉTODOS DE DILUCIÓN |
|
|
|
Dilución en agar (gold standard) |
Serie de placas con agar y concentraciones crecientes de un determinado antimicrobiano, diluido en el propio medio, a las que se añade el inóculo bacteriano estandarizado.3
|
El valor de la CMI lo marca la concentración mínima de antimicrobiano a la cual no se observa crecimiento bacteriano. VENTAJAS: método de referencia para la determinación de la CMI. DESVENTAJAS: engorroso
|
|
Dilución en caldo
|
Medio líquido de cultivo (generalmente Müller-Hilton) con concentraciones crecientes del antimicrobiano al que se añade el inóculo bacteriano estandarizado.
|
El valor de la CMI lo marca la concentración mínima de antimicrobiano a la cual no se observa crecimiento bacteriano. VENTAJAS: las mismas de la dilución en agar junto con la existencia de métodos semiautomatizados para su medición |
|
OTROS MÉTODOS DE DETERMINACIÓN DE RESISTENCIA |
|
|
|
Biología molecular |
PCR para detección de genes asociados a determinadas resistencias bacterianas.
|
|
|
Microarrays |
Detección simultánea de varios genes de resistencia mediante hibridación específica con sondas marcadas. |
|
|
Inmunocromatografía |
Para detección de, por ejemplo, mutaciones en la diana del antibiótico o enzimas microbianas que hidrolizan el antibiótico. |
|
|
Métodos colorimétricos |
Un cambio en el pH del medio ante la hidrólisis del antibiótico por una enzima bacteriana produce un cambio de color en el indicador. |
|
|
Hibridación in situ fluorescente |
(FISH) utiliza sondas fluorescentes para detectar secuencias de ácidos nucleicos específicas de un microorganismo. Sirve tanto para identificar microorganismos como mecanismos de resistencia |
|
|
Espectrometría de masas MALDI-TOF |
Detección de resistencia , a través de la medida en la actividad enzimática (detección de productos resultantes de la hidrólisis enzimática en caso de poseer el microorganismo este mecanismo), del análisis del perfil proteico (picos de masas asociados a ciertos mecanismos de resistencia) o de los efectos antibióticos sobre el crecimiento bacteriano (cuantificando el crecimiento en presencia de un antibiótico) |
|
|
Otros |
Citometría de flujo, nefelometría, quimioluminiscencia. |
|
|
OTROS CONCEPTOS PARA INTERPRETAR EL RESULTADO DE UN CULTIVO |
||
|
Microbiota normal o habitual4 |
Microorganismos (bacterias, hongos, virus y protozoos) colonizadores habituales de la zona corporal de la cual se ha tomado la muestra |
|
|
Microorganismos detectados en el cultivo de la muestra y que no proceden de la zona corporal de la cual se ha tomado la ésta |
|
|
|
Concentración mínima inhibitoria |
Es la mínima concentración de ATB que inhibe el crecimiento del microorganismo testado tras incubación Se mide con exposición del MO a concentraciones con diluciones seriadas. |
Es una medida in vitro que refleja la capacidad del antimicrobiano para inhibir el crecimiento de las bacterias El valor numérico NO es absoluto: depende del microorganismo y el antimicrobiano y del sitio de la infección en algunos casos. |
|
CMB Concentración mínima bactericida |
Concentración mínima de antimicrobiano capaz de matar un 99.9% de la población bacteriana inicial . |
Refleja la posible actividad bactericida del antimicrobiano 5. |
|
EPA Efecto post antibiótico |
Supresión del crecimiento bacteriano posterior a la exposición a un antibiótico in vitro 6 Continuación del efecto bactericida del ATB por periodos prolongados, cuando la concentración del fármaco es mas baja que la CMI. |
El efecto post-antibiótico (EPA) es microorganismo y antimicrobiano-dependiente.7 Se puede modificar la dosificación de los antimicrobianos para aprovechar el EPA. En aquellos fármacos con EPA largo se podría aumentar el intervalo de la dosis. Para los antimicrobianos sin EPA sería más conveniente usar infusión continua en su administración. |
|
CPM Concentración preventiva de mutantes |
Concentración de antibiótico que restringe la amplificación de mutantes resistentes de primer paso dentro de una población sensible. |
Por encima de esta concentración el crecimiento bacteriano solo se espera que ocurra con dos o más mutaciones concomitantes. |
|
VSM Ventana de selección de mutantes |
Rango de concentraciones entre la CMI y la CPM . |
|
|
CMAX/CMI Cociente inhibitorio |
Relación entre el pico sérico de antimicrobiano y la CMI. |
Antibióticos dependientes de concentración. |
|
T >CMI Tiempo sobre CMI
|
Tiempo en que las concentraciones del antimicrobiano están por encima de la CMI del microorganismo. |
Antibióticos dependientes del tiempo. |
|
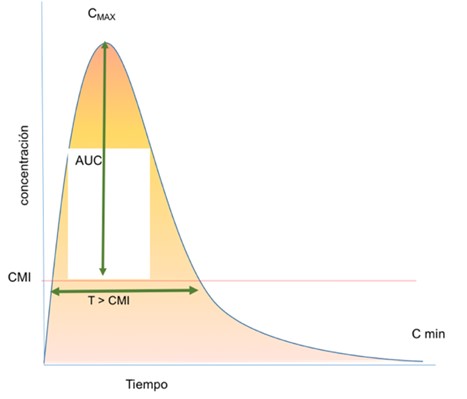
AUC/CMI Tasa área bajo la curva |
Relación entre el área bajo la curva de concentración frente al tiempo de 24 horas y la CMI. |
El AUC es el área bajo una línea trazada en un gráfico de la concentración plasmática de un fármaco en función del tiempo (área rosa y naranja del gráfico). EL AUC/CMI refleja el tiempo en que el antimicrobiano se encuentra en su efecto terapéutico (por encima de la CMI) (área naranja del gráfico)
|
 |
||
|
CLASIFICACIÓN FARMACODINÁMICA DE LOS ANTIBIÓTICOS |
||
|
Desde el punto de vista de la actividad PD, los antibióticos se clasifican en función del tipo de actividad antibacteriana y de la presencia de efecto post-antibiótico (EPA). Así, la actividad antibacteriana puede ser:
Con esto, los antibióticos se pueden clasificar en tres grandes grupos: |
||
|
Antibióticos con actividad concentración dependiente (CD) y prolongado EPA8 |
Para estos antibióticos, los parámetros relacionados con la eficacia son Cmax/CMI y/o el AUC24h/CMI. 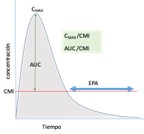
|
Estos antibióticos se utilizan a altas dosis, y el prolongado EPA permite utilizar intervalos de dosificación amplios (por ejemplo, una dosis diaria) |
|
Antibióticos con actividad tiempo dependiente y efecto post-antibiótico mínimo o moderado.9 |
Para estos antibióticos, el tiempo durante el cual las concentraciones permanecen por encima de la CMI (t>CMI) es el parámetro relacionado con la erradicación bacteriana y la respuesta microbiológica. Este parámetro se denomina tiempo de eficacia. 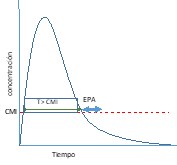 |
Cuanto menor es la semivida de eliminación, mayor es la frecuencia con la que hay que administrar estos antibióticos. Si la semivida es inferior a dos horas es difícil mantener un T>CMI por encima del 100% del intervalo de dosificación10. 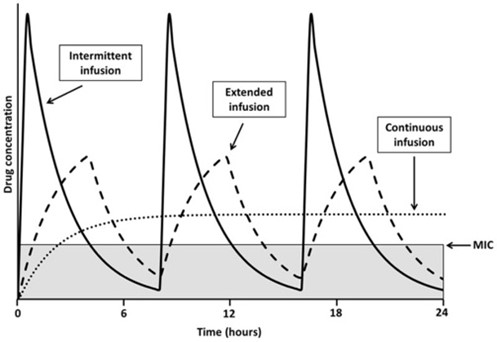 |
|
|
||
|
Antibióticos con actividad concentración- independiente y prolongado EPA11 |
Al aumentar la concentración de estos antibióticos, la erradicación bacteriana aumenta solo ligeramente, pero se consigue una prolongada inhibición del crecimiento. 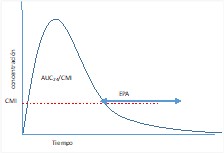 |
El objetivo en estos casos es optimizar la dosis y el AUC24h/CMI es el parámetro relacionado con la eficacia |
|
Valores específicos de parámetros, tales como valores de CMI, según los cuales las bacterias se pueden asignar a las categorías clínicas de sensible (S), intermedio (I) y resistente (R)12 |
Clásicamente, un antibiótico se considera adecuado para tratar una infección causada por una bacteria cuando, administrado en dosis terapéuticas (es decir, no tóxicas), alcanza en el foco de infección concentraciones al menos cuatro o veces superiores a la CMI |
|
|
S: Sensible |
Un MO es definido como (S) por un nivel de actividad antimicrobiana asociado con una alta probabilidad de éxito terapéutico |
Un MO es categorizado como (S) aplicando el punto de corte apropiado en un test fenotípico definido |
|
I: (antes intermedio) sensible Incrementando exposición |
Un MO se categoriza como Sensible, cuando se incrementa la exposición*, cuando hay una alta probabilidad de éxito terapéutico porque la exposición al agente está incrementada por ajuste del régimen de dosificación o por su concentración en el lugar de la infección.13,14 |
Un MO es categorizado como (I) aplicando el punto de corte apropiado en un test fenotípico definido |
|
R: Resistente |
Un MO es definido como (R) por un nivel de actividad antimicrobiana asociado con una alta probabilidad de fracaso terapéutico |
Un MO es categorizado como (R) aplicando el punto de corte apropiado en un test fenotípico definido |
|
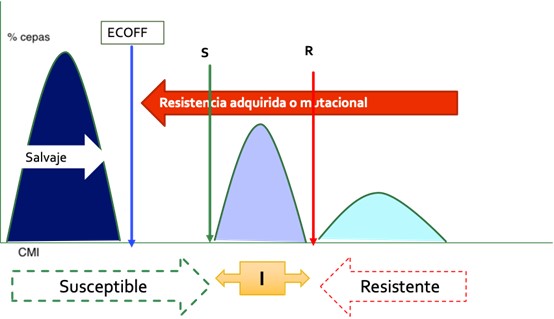
ECOFF: PUNTOS DE CORTE EPIDEMIOLÓGICOS |
|
|
Separa las poblaciones que no presentan/expresan mecanismos de resistencias de aquellas que sí lo hacen Mayor utilidad para la lectura interpretada del antibiograma No coinciden necesariamente con los puntos de corte clínicos Desde el punto de vista microbiológico la distribución de valores de concentración mínima inhibitoria (CMI) o de diámetros de halo de inhibición (obtenidos mediante métodos estandarizados de antibiograma) permite, idealmente, separar para cada especie la subpoblación que carece de mecanismos de resistencia adquiridos (fenotipo salvaje) de la que sí tiene dichos mecanismos. |
Estos puntos de corte epidemiológicos (ECOFF) pueden estimarse empleando procedimientos estadísticos, son conceptualmente invariables, no dependen de las dosis de antimicrobiano que puedan utilizarse y no necesariamente tienen que coincidir con los puntos de corte para definición de categorías clínicas15 |
|
|
|
Interpretación de los ECOFF : clasificación de los fenotipos de resistencia adquirida de los MO |
||
|
Fenotipo salvaje (WT) |
Un MO es definido como fenotipo salvaje (WT) para especies en ausencia de mecanismos de resistencia adquiridos y mutaciones para el fármaco en cuestión |
Un MO es categorizado como (WT) para una especie aplicando punto de corte (ECOFF) apropiado en un test fenotípico definido16,17 |
|
Resistencia microbiológica (Fenotipo no salvaje (NWT) |
Un MO es definido como NWT para una especie por la presencia de un MR adquirido o mutacional para el fármaco en cuestión |
Un MO es categorizado como NWT aplicando el punto de corte apropiado en un test fenotípico definido 16,17
|
 |
||
|
RESISTENCIA ANTIMICROBIANA |
||
|
RESISTENCIA NATURAL O INTRÍNSECA |
Aquella expresada por los fenotipos salvajes. La resistencia natural es propia de cada familia, especie o grupo bacteriano. |
Es necesario conocerla antes de iniciar la antibioterapia empírica18. |
|
RESISTENCIA ADQUIRIDA |
Variable, adquirida por una cepa de un microorganismo que en principio era sensible a un antimicrobiano mediante mutación o transferencia horizontal de material genético |
Es necesario conocer la epidemiología de las resistencias adquiridas en nuestra comunidad antes y durante el tratamiento antibiótico19. |
|
FENOTIPOS DE RESISTENCIA |
||
|
Tipo |
Definición |
Ejemplo |
|
Fenotipos de resistencia habituales |
En el medio epidemiológico del área de estudio
|
Producción de beta-lactamasas tipo TEM en E. coli; S. aureus meticilin resistente (MRSA). |
|
Fenotipos raros
|
Son consecuencia de la expresión de mecanismos de resistencia poco habituales, recientemente caracterizados o cuya dimensión epidemiológica es por el momento poco relevante en el área geográfica de estudio. |
S. aureus resistente a vancomicina; P. aeruginosa resistente a colistina. |
|
Fenotipos imposibles |
Estreptococos grupo A, B, C resistente a penicilina. |
|
|
FENOTIPOS ESPECÍFICOS |
|||||
|
Gram positivos |
|||||
|
MO |
Infecciones |
Fenotipos de Resistencia |
|||
|
Streptococcus pyogenes (SGA) |
Principal bacteria causal de faringoamigdalitis. Infecciones de piel y partes blandas (erisipela, impétigo, ectima). Neumonía. Infecciones músculoesqueléticas. Infecciones del área ORL |
No existen descritas resistencias a penicilina /amoxicilina (FENOTIPO IMPOSIBLE)22. Sensible por tanto al resto de grupo de ß-lactámicos activos frente al mismo, Frecuente resistencia a macrólidos (15-20%), distinguiéndose dos fenotipos23,24:
Resistencia a quinolonas, generalmente de bajo nivel: mutaciones acumulativas en las enzimas intracelulares diana del antibiótico: ADN girasa y topoisomerasa IV. |
|||
|
Streptococcuspneumoniae25 (Neumococo) |
Principal bacteria causal de neumonía adquirida en la comunidad (NAC). Infecciones del área ORL (OMA, rInosinusitis, mastoiditis). Sepsis / meningitis. |
Disminución de la sensibilidad a amoxicilina debido a mutaciones en las PBPs (penicillin-binding proteins), excepcionalmente resistentes (TABLA 1). ➔ Disminución de sensibilidad superable con aumento de dosis salvo en caso de infecciones en lugares que no permiten un aumento de concentración del antibiótico (SNC). ➔ La resistencia a amoxicilina no es dependiente de enzimas hidrolizantes (por tanto, NO se benefician de asociar inhibidores de beta-lactamasas como el ácido clavulánico). Frecuente resistencia a macrólidos (10-40% con diferencias regionales), distinguiéndose dos fenotipos23,24:
Resistencia a quinolonas, generalmente de bajo nivel: mutaciones acumulativas en las enzimas intracelulares diana del antibiótico: ADN girasa y topoisomerasa IV). |
|||
 |
|||||
|
MO y tipo de infección |
Fenotipos de Resistencia |
||||
|
Staphylococcus aureus Infecciones cutáneas y de partes blandas Infecciones osteoarticulares Bacteriemia Endocarditis Neumonía
|
Resistencia casi universal (>90%) a penicilina/amoxicilina, conferida por la existencia de penicinilasas (ß-lactamasa de clase molecular A de Ambler (subtipos A, B, C y D) que no hidroliza penicilinas semisintéticas como la oxacilina ni cefalosporinas, siendo además sensible a la acción de inhibidores de ß-lactamasa como el ácido clavulánico). ➔ Beta-lactámicos con especial actividad antiestafilocócica (SASM):
Resistencia de bajo nivel (BORSA: borderlineoxacillin-resistantS.aureus): cepas con CMIs en los límites de los puntos de corte (CMI 4-8)30 Resistencia a beta-lactámicos (PBP2a con baja afinidad a betalactámicos codificadas por los genes mecA o mecC):
Dentro de los S.aureus resistentes a oxacilina podemos distinguir dos subgrupos: |
||||
|
Staphylococcus aureus resistente a meticilina (SARM) |
|||||
|
ORIGEN /PATOLOGÍA ASOCIADA |
CASETTE CROMOSÓMICO |
RESISTENCIAS ASOCIADAS |
|||
|
SARM-H Asociado a cuidados de salud Infecciones cutáneas y de partes blandas, infecciones osteoarticulares, bacteriemia, endocarditis, neumonía. |
SCC mec de tipo I, II y III |
Multirresistencia; generalmente asocia resistencias a múltiples grupos antibióticos Suele requerir tratamiento con glucopéptidos, daptomicina o linezolid |
|||
|
SARM-C Generalmente comunitario Infecciones cutáneas y de partes blandas, neumonía. |
SCC mec de tipo IV y V |
Generalmente limitada a los beta-lactámicos, si bien hay clones que pueden asociar otras resistencias. |
|||
|
ENTEROBACTERIAS |
|||||
|
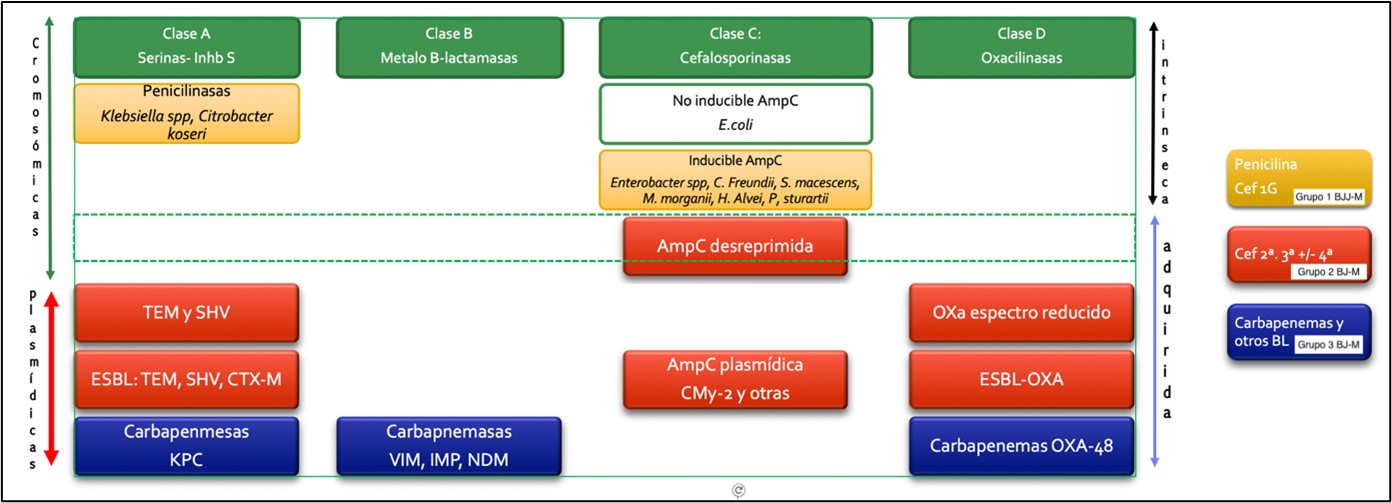
El principal mecanismo de resistencia31 a betalactámicos en enterobacterias es el enzimático, por producción de las betalactamasas. Las betalactamasas son enzimas que degradan el anillo betalactámico y actúan como mecanismos de resistencia natural de algunas bacterias.32,33,34 Las betalactamasas pueden clasificarse según su estructura de aminoácidos en cuatro clases moleculares, de la A a D , como sugirió por primera vez Ambler. 35 Por otra parte, el sistema de clasificación de Bush-Jacoby-Medeiros divide las enzimas en varios grupos funcionales de acuerdo con el perfil de su sustrato y sensibilidad a los inhibidores de ß-lactamasa, como el ácido clavulánico (tabla 2)
|
|||||
 |
|||||
|
FENOTIPOS DE RESISTENCIA NATURAL36 Las enterobacterias de interés clínico, con la única excepción de Salmonella y Proteus mirabilis, son portadoras de una betalactamasa cromosómica natural propia de cada especie, y se pueden dividir en 4 grupos: |
Grupo1: E. coli, Shigella, Salmonella enterica y P. mirabilis. Fenotipo sensible a todos los betalactámicos. 37 |
||||
|
Grupo 2: Klebsiella spp, Citrobacter koseri y Citrobacter amalonaticus, y otras. Resistencia de bajo nivel a aminopenicilinas (ampicilina) y carboxipenicilinas (ticarcilina) y sensibilidad disminuida o intermedia a ureidopenicilinas (piperacilina), sensibles a cefalosporinas, monobactámicos (aztreonam), carbapenémicos (imipenem) y a las asociaciones con inhibidores de betalactamasa (amoxicilina-ác. clavulánico). |
|||||
|
Grupo 3: Citrobacter freundii, Enterobacter spp., Providencia spp., Morganella morganii, Serratia spp., Hafnia alvei, Proteus vulgaris, y P. penneri. Betalactamasa cromosómica inducible con actividad cefalosporinasa. Fenotipo resistente a aminopenicilinas y cefalosporinas de primera generación , sensibles a carboxipenicilinas y ureidopenicilinas, cefalosporinas de tercera y cuarta generación, monobactámicos y carbapenémicos.38,39 |
|||||
|
Grupo 4: Yersinia enterocolitica con producción de cefalosporinasa inducible y penicilinasa.Fenotipo resistente a aminopenicilinas, carboxipenicilinas, amoxicilina-ácido clavulánico y cefalospoirinas de primera y segunda generación. 40 |
|||||
|
Tipos de Betalactamasas |
|||||
|
Penicilinasas |
Son las betalactamas clásicas.(Clase A Amber, 2b Bush-Jacoby). TEM-1, TEM-2, SHV. Resistencia a aminopenicilinas, carboxpenicilinas. Mantienen S a cefalosporinas monobactámicos y carbapenemes. 41 |
||||
|
Betalactamasas R a inhibidores (IRT, OXA) 42 |
Derivan TEM-1 y TEM-2, y algunas de SHV-1. Algunas oxacilinasas grupo D, como la OXA-143, también confieren un fenotipo similar al de las IRT, con resistencia a inhibidores como el clavulánico. La detección es posible en bacterias naturalmente S a clavulánico (E. coli) 44 pero es difícil en aquéllas que presenta ampC inducible (Enterobacter, Serratia) donde se deben detectar por mecanismos moleculares. Ante la presencia de enzimas tipo IRT u OXA, deberíamos prescindir de tratamientos con las asociaciones de antibióticos betalactámicos e inhibidores de betalactamasa como amoxicilina-ácido clavulánico y ampicilina-sulbactam. |
||||
|
Betalactamasas de espectro extendido (BLEE) |
Las primeras BLEE descritas derivaban de las TEM-1, TEM-2 y SHV-1. Hay otras familias de BLEE como las CTX-M, cuyo origen se encuentra en las cromosómicas de ciertas especies, con gran expansión. En el laboratorio la detección se basa en la capacidad de estas enzimas de hidrolizar las cefalosporinas de tercera y cuarta generación y los monobactámicos, disminuyendo por tanto la sensibilidad de la bacteria a estos antibacterianos. 45 Las BLEE se caracterizan por ser capaces de inactivar la práctica totalidad de cefalosporinas a excepción de las cefamicinas, manteniendo la sensibilidad a los inhibidores y a los carbapenémicos, siendo inhibidas por el ácido clavulánico46,47 |
||||
|
Hiperproducción de betalactamasa cromosómica de clase C y AmpC plasmídicas |
Fenotipo caracterizado por presentar resistencia a la práctica totalidad de betalactámicos con la única excepción de los carbapenémicos, aunque las diferentes cefalosporinas serán más o menos hidrolizadas en función del nivel de hiperproducción. 48 En el caso de una betalactamasa desreprimida, aún siendo sensible in vitro, se deben evitar cefalosporinas de tercera generación y monobactámicos por la posibilidad de fracaso terapéutico por la selección de cepas resistentes por desrepresión de la betalactamasa cromosómica. Sin embargo, la actividad frente a cefalosporinas de cuarta generación y carbapenémicos se mantiene, siempre que no se combinen otros mecanismos de resistencia. |
||||
|
Carbapenemasas: Enzimas asociadas a elementos transferibles que hidrolizan carbapenémicos |
Las metalo-betalactamasas pertenecen a la clase B o grupo 3 de Bush y Jacoby. Las enzimas principales son las IMP y VIM que tienen un perfil hidrolítico que incluye todos los antibióticos betalactámicos con la excepción del aztreonam y no se inhiben por el ácido clavulánico, sulbactan o tazobactam.49 De las carbapenemasas de clase A (grupo 2f),las más importantes son las denominas KPC que hidrolizan de forma eficiente penicilinas, cefalosporinas y carbapenémicos. 50 No se inhiben por el ácido clavulánico, pero sí por el ácido borónico, inhibidor que se utiliza para su reconocimiento fenotípico. Otras carbapenemasas pertenecen al grupo OXA (clase D de Ambler y 2df de Bush y Jacoby) sobre todo la OXA-48 descrita en enterobacterias en países mediterráneos. En un antibiograma de K. pneumoniae o E. coli OXA-48, se mostrarían resistentes a las penicilinas y sus asociaciones con los inhibidores de betalactamasas de clase A, sensibles a las cefalosporinas y con pérdida de sensibilidad a los carbapenémicos.51 El screening de carbapenemasas se realiza cuando los valores de CMI a carbapenémicos está por encima del cutoff52,53. |
||||
|
CLASIFICACIONES COMPARADAS DE BETALACTAMASAS |
||||||
|
AMBLER |
BJM 2009 |
SUSTRATO |
INHIBIDA POR |
Representantes |
||
|
Clav. o TZB |
EDTA |
|
||||
|
A |
2a |
Penicilina |
Si |
No |
PC-1 |
|
|
2b |
Pen. Cef 1ª G |
Si |
No |
TEM-1, TEM-2, SHV-1 |
||
|
2be |
Cef. espectro extendido y monobactámicos |
No |
No |
TEM-3, SHV-2, CTX-M-15, PER-1, VEB-1 |
||
|
2br |
Penicilinas |
No |
No |
TEM-30, SHV-10 |
||
|
2ber |
Cef. espectro extendido y monobactámicos |
No |
No |
TEM-50 |
||
|
2c |
Carbenicilinas |
Si |
No |
PSE-1, CARB-3 |
||
|
2ce |
Carbenicilina y cefepime |
Si |
No |
RTG-4 |
||
|
2e |
Cef. espectro extendido (no monobactámicos) |
si |
No |
CepA |
||
|
2f |
Carbapenemes |
Variable |
No |
KPC-22 IMI-1 SME-1 |
||
|
B |
3a |
Carbapenemes |
No |
Si |
IMP-1, VIM-1, CcrA, IND-1 |
|
|
3b |
Carbapenemes |
No |
Si |
CAu-1, FEZ-1, GOB-1 |
||
|
C |
1 |
Cefalosporinas, cefamicinas |
No |
No |
E. coliAmpC, CMY-2, FOX-1, MIR-1, ACT-1 |
|
|
1e |
Cefalosporinas, (ceftazimdima, oxymino beta lactámcios) |
No |
No |
GC1, CMY-37 |
||
|
D |
2d |
Cloxacilina |
Variable |
No |
OXA-1, OXA-10 |
|
|
|
2de |
Cef. espectro extendido |
Variable |
No |
OXA-11, OXA-15 |
|
|
|
2df |
Carbapenemes |
Variable |
No |
OXA-23, OXA-48 |
|
|
| Referencias bibliográficas |
|
Abreviaturas: Abreviaturas: ADN: ácido desoxirribonucleico. ATB: antibiótico. AUC: área bajo la curva (“areaunderthe curve). BLEE/BLEA: betalactamasas de espectro extendido o ampliado.BORSA: S. aureuscon resistencia límite a la oxacilina (“borderlineoxacillin-resistantS. aureus).CD: concentración-dependiente. CLSI: “clinical and laboratorystandardsinstitute”.CMB: comcentración mínima bactericida. CMI: concentración mínima inhibitoria. CPM: concentración preventiva de mutantes. ECOFF: puntos de corte epidemiológicos (“epidemiologicalcut-off values). EPA: efecto postantibiótico. EUCAST: “europeancommitteeonantimicrobialsusceptibilitytesting”. FAA: faringoamigdalitis aguda.I: intermedio. LCR: líquido cefalorraquídeo. MALDI-TOF: desorción-ionización láser asistida por matriz-tiempo de vuelo (“Matrix-assisted laser desorption/ionization time-of-flight).MO: microorganismo. MRSA: S. aureusresistente a meticilina (“methicillin-resistantS. aureus). NAC: neumonía adquirida en la comunidad. NWT: fenotipo no savaje (“non wild type”). OMA: otitis media aguda. PBP: proteínas fijadoras de penicilina (“penicillin-bindingproteins. PCR: reacción en cadena de la polimerasa (“Polymerasechainreaction”). Pk/Pd: farmacocinética/farmacodinamia. ). R: resistente. S: sensible. SASM: S. aureussensible a meticilina. SARM: S. aureusresistente a meticilina.SGA: Streptococcusgrupo A. VSM: ventana de selección de mutantes. WT: fenotipo salvaje (“wild type”).
1 Los valores numéricos de CMI no son comparables entre cada tipo de antimicrobiano, pues los puntos de corte que diferencian las categorías clínicas son distintos en cada uno de ellos.
2 Modificaciones cada vez menos necesarias desde el establecimiento de los criterios de Pk/Pd.
3 Opcionalmente permite el estudio de la capacidad bactericida mediante subcultivos en medio sin antimicrobiano.
4 Microrganismos que componen la flora habitual. En ocasiones, cuando se adquieren cepas con especial virulencia, el huésped se encuentra inmunocomprometido o cuando se pierde el equilibrio ecológico con el resto de comensales, pasan a ser agentes patógenos (por ejemplo S. aureus en piel, o Cándida sp en vagina).
5 No es una medida usualmente utilizada en la práctica clínica, salvo en infecciones concretas como endocarditis u osteomielitis.
6 Se refiere al tiempo que se requiere para que la bacteria recupere el crecimiento normal después de la exposición al agente antimicrobiano.
7 Aquellos fármacos que actúan por concentración pico tienen mayor efecto post antibiótico; por ejemplo, los aminoglucósidos y ciprofloxacino tienen un EPA en bacilos Gram (-)s de 2 a 6 horas. Los beta-lactámicos no tienen EPA en bacilos Gram (-)s y sólo de 2 horas en Gram (+)s.
8 Ejemplos de este grupo son: aminoglucósidos: Cmax/CMI ≥ 10-12; fluoroquinolonas: AUC24h/CMI ≥ 25-30 (infecciones no graves e infección respiratoria por Streptococcus pneumoniae). AUC24h ≥ 125 (infecciones graves y en inmunodeprimidos);metronidazol:índice PK/PD no establecido; daptomicina: AUC24h/CMI ≥ 666
9 Ejemplos de este grupo son: betalactámicos: penicilinas T>CMI >50% (el tiempo durante el cual la concentración de fármaco libre está por encima de la CMI debe ser superior al 50% del intervalo de dosificación); cefalosporinas y aztreonam T>CMI >60-70%; carbapenemas T>CMI >40%.
10 El objetivo de la terapia es conseguir una larga exposición al antibiótico. En algunos casos, la perfusión continua es la forma más efectiva de administrar estos antibióticos, especialmente si se requiere un valor alto de t>CMI.
11 Vancomicina: AUC24h/CMI ≥ 400;linezolid. AUC24h/CMI ≥ 100;tetraciclinas. AUC24h/CMI ≥ 15-25;clindamicina. Índice PK/PD no establecido ; azitromicina. AUC24h/CMI ≥ 25; tigeciclina: AUC24h≥ 15-20
12 Los puntos de corte son establecidos por agencias oficiales con comités técnicos que van estandarizando y actualizando la información. Clásicamente era la americana CLSI la que los ha determinado (si bien existen otras). En 1997 se forma el comité europeo EUCAST, actualmente de referencia en nuestro país. Los puntos de corte para establecer las categorías clínicas (S, I y R) se realizan utilizando criterios microbiológicos, farmacológicos (PK/PD) y clínicos.
13 Por ej, cefalosporinas 1ªG en orina frente a E. coli, o cuando una alta dosis del fármaco pueda ser usada sin efectos adversos (por ej. Infecciones extrameníngeas por S. pneumoniae tratadas con altas dosis de amoxicilina VO).
14 También puede indicar una zona tampón que debe evitar que pequenÌos factores técnicos no controlados puedan causar una discrepancia importante en las interpretaciones
15 Aún cuando los puntos de corte epidemiológicos no se emplean para atender a pacientes concretos, sí que tienen interés biomédico claro, pues permiten detectar cambios sutiles en el patrón de sensibilidad de los microorganismos y pueden ser de ayuda para medir el efecto de intervenciones para la contención de la resistencia
16 Este valor NO será alterado por otras circunstancias
17 Estos microorganismos pueden o no responder clínicamente a un tratamiento antimicrobiano
18 Por ejemplo, todas las bacterias gram negativas son resistentes a la vancomicina, y esta situación no es variable.
19 Así, existen cepas de neumococo que han adquirido resistencia a la penicilina o macrólidos, cepas de Escherichia coli resistentes a la ampicilina, cepas de estafilococos resistentes a la meticilina, producción de beta-lactamasas.
20 En la mayoría de los casos no se confirman con un nuevo estudio de sensibilidad y suelen representar problemas técnicos en la realización de las pruebas de sensibilidad o fallos en la identificación del microorganismo en el que se realiza el estudio.
21 Si se confirma la identificación de la cepa y se reproduce la resistencia encontrada, puede suponer un nuevo mecanismo de resistencia que se debe identificar y remitir la cepa al laboratorio de referencia.
22 Sin embargo, existen descritos fallos de tratamiento con penicilina en FAA, no debidos a una falta de sensibilidad a la misma sino a otros factores (mala penetrancia del antibiótico en amígdalas, protección conferida por ß-lactamasas procedentes de otras bacterias de la flora orofaríngea, desequilibrios en la flora comensal). La decisión de instaurar tratamiento con cefalosporinas en lugar de penicilina o amoxicilina no dependerá por tanto del perfil de resistencias como de la situación clínica (por ejemplo, en caso de infecciones recurrentes).
23 En caso de resistencia a macrólidos, especialmente en caso de resistencias de alto nivel o enfermedad grave, debemos evitar el uso de clindamicina por la posibilidad de resistencia asociada (incluso en casos de sensibilidad “in vitro” sin test de inducción).
24 En nuestro medio predominan el fenotipo M en SGA y el fenotipo MLSB en neumococo.
25 Disminución de la tasa de resistencias tras la implantación de las vacunas antineumocócicas conjugadas.
26 La oxacilina, antibiótico tiempo-dependiente, precisa intervalos cortos de administración (valorándose incluso infusiones contínuas). En caso de infecciones graves el objetivo es mantener 100% del tiempo concentraciones por encima de la CMI, o incluso 4 veces por encima de la misma para evitar la selección de cepas resistentes.
27 En caso de infecciones con “efecto inóculo” (elevada población bacteriana, como por ejemplo en la endocarditis) el efecto de los beta-lactámicos puede quedar limitado. Esto es debido a que muchas de ellas quedarán en fase estacionaria, limitando así la acción de este grupo farmacológico, quedando además el antibiótico más sensible a la acción de las beta-lactamasas; la ß-lactamasa subtipo A posee una mayor capacidad de hidrolizar la cefazolina en estas condiciones, y la C de hacerlo con la cefalexina, siendo además menos sensible a la acción del ácido clavulánico. Este efecto es menos marcado en el caso de meticilina y cloxacilina.
28 Especialmente útil en casos como las infecciones que incluyen formación de biopelículas, graves originadas por cepas productoras de leucocidina de P-valentine o situadas en áreas poco accesibles al antimicrobiano administrado o de alto inóculo.
29 S. aureus presenta una buena sensibilidad in vitro a cloxacilina pero in vivo no queda garantizada la consecución del objetivo farmacodinámico necesario para tratar enfermedades moderadas o graves, a consecuencia de unos parámetros PK/PD que le confieren una baja biodisponibilidad (50-75%), como son: una vida media corta baja (es un fármaco tiempo-dependiente) y un alto porcentaje de fijación a proteínas plasmáticas (94%), que determina la existencia de una menor fracción libre en suero. Por el contrario, cefadroxilo presenta una biodisponibilidad >90%, con una vida media mayor y un bajo porcentaje de fijación a proteínas plasmáticas (<20%). Asímismo, presenta la ventaja con respecto a la asociación de penicilinas con inhibidores de ß-lactamasas o cefalsoporinas de segunda generación de provocar una menor disrupción en la microbiota intestinal.
30 Se puede corresponder a poblaciones heterorresistentes (comprende bacterias portadoras y no portadores del gen mecA) o bien a otro mecanismo, como pueden ser la sobreexpresión las betalactamasas estafilocócicas o la alteración de las PBP 1, 2 ó 4.
31 Otros mecanismos de resistencia a betalactámicos (por ejemplo disminución de permeabilidad) pueden coexistir junto con la producción de betalactamasas dificultando la interpretación del antibiograma.
32 La emergencia de la resistencia los betalactámicos comenzó desde que se desarrolló la penicilina, y la primera betalactamasa fue identificada en E. coli antes del uso clínico de la penicilina (Abraham, 1940). Con el uso de la penicilina, emergió rápidamente la resistencia de S. aureus por una penicinilasa que se propagó rápidamente a otros estafilococos.
33 Muchos gram-negativos poseen una resistencia natural mediada por betalactamasas cromosómicas, posiblemente desarrollada por los organismos productores de betalactámcios en el ambiente.
34 La primera betalactamasa identificada en gram-negativos fue la TEM-1 en E. coli (de la paciente griega Temoneira) en los 60’, y fue diseminada a otras especies mediante plásmidos y trasposones; ahora la encontramos en especies de enterobacterias, P. aeruginosa, H. influenzae y N. gonhorroeae. Otra betalactamsa común es la SHV-1 (variable sulfihídrca), que está codificada de forma cromosómica en K. pneumonaie,y mediada por plásmidos en E. coli.
35 Las betalactamasasde clase A, C y D hidrolizan el anillo ß-lactámico a través de un residuo serina en su lugar activo, mientras que las enzimas de clase B son metalo-ß-lactamasas que usan zinc (Zn2+) para romper el enlace amida.
36 Conocer la resistencia natural sirve para valorar si los mecanismos de resistencia son adquiridos, si la antibioterapia empírica es adecuada y si presentan fenotipos imposibles (por ejemplo Klebisella spp.S a ampicilna)
37 Tanto E. coli como Shigella son portadoras de una betalactamasa cromosómica de clase C de Ambler que en su forma natural o salvaje se expresa a nivel muy bajo, y no confiere resistencia de trascendencia clínica.
38 C. freundii, Enterobacter, Providencia, M. morganii, Serratia y H. alvei, presentan una betalactamasa inducible de clase C que les confiere resistencia a las asociaciones de inhibidores y una sensibilidad variable a cefoxitina.
39 P. vulgaris y P. penneri son portadores de una betalactamasa cromosómica de clase A, confiriendo R a cefuroxima (cefuroximinasa) siendo sensibles a cefoxitina y a las asociaciones con inhibidores de la betalactamasa.
40 Este fenotipo es producto de la síntesis de enzimas clase A y clase C.
41 Una hiperproducción conlleva resistencia a cefalosporinas de primera y segunda generación con sensibilidad intermedia a amoxicilina-clavulánico. La hiperproducción de SHV en e. coli y K. pneumoniaemuestra resistencia a ceftazidima que en la técnica de sinergia de disco pude simular la presencia de una BLEE.
42 La asociación amoxicilina-ácido clavulánico presenta actividad frente a un gran número de enterobacterias incluyendo las resistentes a la amoxicilina por producción de betalactamasas de amplio espectro como TEM-1, TEM-2 o SHV-1. Estas betalactamasas hidrolizan penicilinas (aminopenicilinas [ampicilina, amoxicilina], carboxipenicilinas [ticarcilina]) son sensibles a los inhibidores de betalactamasa. Por mutaciones aparecieron las betalactamasas resistentes a la inhibición por los inhibidores de betalactamasas.
43 Una característica de las enzimas de tipo OXA es que generalmente presentan una menor sensibilidad a cefepima. Debido a una cierta actividad del ácido clavulánico y a la menor sensibilidad de cefepima, es frecuente observar (mediante la técnica de disco-difusión) sinergia entre el ácido clavulánico y cefepima, siendo este patrón característico de las enzimas tipo OXA-1.
44 Generalmente, una cepa que expresa una betalactamasa de tipo IRT presentará resistencia a aminopenicilinas, carboxipenicilinas, ureidopenicilinas (en mayor o menor medida) y sensibilidad disminuida o resistencia a amoxicilina-ácido clavulánico. generalmente suele mantenerse o disminuir levemente la sensibilidad a piperacilina-tazobactam, posiblemente por la acción intrínseca de la piperacilina.
45 Elscreening de producción de BLEE se realiza si la CMI a cefotaxima/ceftazidima es > 1ug/ml. Se realiza, dependiendo del grupo de enterobacteria, con cefotaxima-cefepime +/- clavulánico, bien por técnicas sinergia disco, dilución caldo, test colorimétricos. También es posible la confirmación genotípica.
46 Desde su descripción inicial, se han identificado más de 300 BLEE diferentes, y la mayoría pertenece a las familias TEM, SHV y CTX-M.
47 El laboratorio debe informar los resultados de CMI de cada antibiótico obtenidos in vitro. El éxito del tratamiento va a depender de factores como el efecto inóculo y el sitio de infección.
48 E. coli y Shigella presenta betalactamasa cromosómica constitutiva de clase C que normalmente se expresa a niveles muy bajos, por lo que no confiere resistencia clínica peroen hiperprpducción, confiere resistencia a aminopenicilinas, carboxipenicilinas, ureidopenicilinas, las asociaciones con inhibidores, cefalosporinas de primera generación cefamicinas y en función del grado de hiperproducción, también puede afectar a cefalosporinas tercera generación monobactámicos, mientras que las C4G y los carbapenémicos se mantienen activos. Las enterobacterias del grupo 3 (Enterobacter, Serratia, Providencia, M. morganii y C. freundii ) presentan una AmpC inducible que en infecciones graves, de alto inóculo en tratamiento con cefalosporinas o monobactámicos se desreprime con selección de mutantes e hiperproducción.
49 Las enzimas KPC se han descrito no solo en Enterobacteriaceae sino también en P. aeruginosa y en A. baumannii.
50 Con las cefamicinas los valores de CMI suelen estar por encima del punto de corte de sensibilidad.
51 La detección fenotípica de OXA-48 es compleja ya que la hidrólisis de los carbapenémicos es poco eficiente y prácticamente inexistente para las cefalosporinas de tercera y cuarta generación El perfil de sensibilidad que confieren mantiene las características generales de las OXA al ser poco inhibida por el ácido clavulánico, sulbactam o tazobactam.
52 Meropenem S/I con CMIS ≤2 y Ecoff >0.125 , es el más adecuado. Ertapenem es muy sensible pero poco específico.
53 La confirmación se realiza mediante test fenotípicos, colorimétricos, moleculares (sobre todo para las tipo OXA).
| Notas: la Guía-ABE se actualiza periódicamente. Los autores y editores recomiendan aplicar estas recomendaciones con sentido crítico en función de la experiencia del médico, de los condicionantes de cada paciente y del entorno asistencial concreto; así mismo se aconseja consultar también otras fuentes para minimizar la probabilidad de errores. Texto dirigido exclusivamente a profesionales. | |||
|
[i] Más información en:
http://www.guia-abe.es/
[*] Comentarios y sugerencias en: laguiaabe@gmail.com |
Novedades
- Meningitis bacteriana
- Cistitis aguda en niños mayores de 12 años y adolescentes
- Infección del tracto urinario (ITU)
- Clostridioides difficile
- Mastoiditis aguda
 Tema nuevo
Tema nuevo  Tema actualizado
Tema actualizado Lo más leído
- Infecciones de la piel y partes blandas (I): impétigo, celulitis, absceso
- Balanitis
- Gastroenteritis aguda
- Descripción general de los principales grupos de fármacos antimicrobianos. Antibióticos.
- Infecciones de la piel y partes blandas (II): heridas (tratamiento, profilaxis general y antitetánica)








